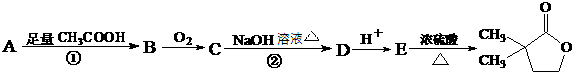
题目内容
若将NaHSO4与Ba(OH)2在溶液中按物质的量之比为2:1混合,则发生反应的离子方程式为 ,此时溶液呈 性.
考点:离子方程式的书写
专题:
分析:根据NaHSO4与Ba (OH)2在溶液中离子之间反应的实质来回答;依据离子反应方程式判断溶液呈的酸碱性.
解答:
解:NaHSO4与Ba (OH)2在溶液中按物质的量之比为2:1混合时,酸碱恰好中和,实质是:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故答案为:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O;中性.
点评:本题考查学生离子方程式的书写知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
下列各组分自己中,都属于含极性键的非极性分子的是( )
| A、CO2 H2S |
| B、C2H4 CH4 |
| C、C60 C2H2 |
| D、NH3 HCl |
随着科学技术的不断进步,研究物质的手段和途径越来越多,N3+、H3、O4、C50等已被发现,下列有关说法中,正确的是( )
| A、N3+离子中含有36个电子 |
| B、O2与O4属于同位素 |
| C、C50是原子晶体 |
| D、H2与H3互称为同素异形体 |
体积为V mL,密度为ρ g?cm3的溶液,含有摩尔质量为M的溶质m g,其物质的量的浓度为c mol?L-1,溶质的质量分数为w%,则下列表达式正确的是( )
A、c=
| ||
B、m=V?ρ
| ||
C、w%=
| ||
D、c=
|
某同学在做中和热的测定实验时,有些操作不规范,造成测得中和热的数值偏高,请你分析可能的原因( )
| A、测量盐酸的温度后,温度计没有用水冲洗干净 |
| B、把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓 |
| C、量取盐酸时仰视读数 |
| D、将50 mL 0.55 mol/L氢氧化钠溶液取成了50 mL0.55 mol/L的氨水 |