题目内容
有一包白色固体混合物,可能由Na2CO3、K2SO4、BaCl2、NaCl中的几种混合而成.对此混合物进行以下实验:
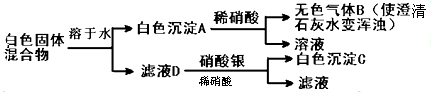
(1)书写下列物质的化学式:A ,C .
(2)白色固体混合物中一定含有 ,一定不含有 ,可能含有 .
(3)写出下列反应的离子方程式:
①混合物溶于水生成白色沉淀A ;
②A溶于稀硝酸的反应 ;
③滤液D与硝酸银溶液的反应 .

(1)书写下列物质的化学式:A
(2)白色固体混合物中一定含有
(3)写出下列反应的离子方程式:
①混合物溶于水生成白色沉淀A
②A溶于稀硝酸的反应
③滤液D与硝酸银溶液的反应
考点:几组未知物的检验
专题:物质检验鉴别题
分析:该固体物质溶于水,会得到白色的沉淀,沉淀溶于硝酸产生二氧化碳,所以沉淀是碳酸钡,一定含有Na2CO3、BaCl2,则一定不会含有K2SO4,滤液加入硝酸银产生白色沉淀,所以有氯化银生成,含有氯离子,但是氯化钡含有氯离子,所以是否含有氯化钠不能确定,据此回答判断.
解答:
解:该固体物质溶于水,会得到白色的沉淀,沉淀溶于硝酸产生二氧化碳,所以沉淀A是碳酸钡,一定含有Na2CO3、BaCl2,则一定不会含有K2SO4,滤液加入硝酸银产生白色沉淀C,所以有氯化银生成,含有氯离子,但是氯化钡含有氯离子,所以是否含有氯化钠不能确定,
(1)该固体物质溶于水,会得到白色的沉淀A是BaCO3,滤液加入硝酸银产生白色沉淀C是AgCl,故答案为:BaCO3;AgCl;
(2)白色固体混合物中一定含有Na2CO3、BaCl2,则一定不会含有K2SO4,可能含有NaCl,故答案为:Na2CO3、BaCl2;K2SO4;NaCl;
(3)①混合物溶于水生成白色沉淀A的离子方程式为:CO32-+Ba2+=BaCO3↓,故答案为:CO32-+Ba2+=BaCO3↓;
②BaCO3溶于稀硝酸的反应为:BaCO3+2H+=Ba2++CO2↑+H2O,故答案为:BaCO3+2H+=Ba2++CO2↑+H2O;
③滤液D中含有氯离子,与硝酸银溶液的反应是:Ag++Cl-=AgCl↓,故答案为:Ag++Cl-=AgCl↓.
(1)该固体物质溶于水,会得到白色的沉淀A是BaCO3,滤液加入硝酸银产生白色沉淀C是AgCl,故答案为:BaCO3;AgCl;
(2)白色固体混合物中一定含有Na2CO3、BaCl2,则一定不会含有K2SO4,可能含有NaCl,故答案为:Na2CO3、BaCl2;K2SO4;NaCl;
(3)①混合物溶于水生成白色沉淀A的离子方程式为:CO32-+Ba2+=BaCO3↓,故答案为:CO32-+Ba2+=BaCO3↓;
②BaCO3溶于稀硝酸的反应为:BaCO3+2H+=Ba2++CO2↑+H2O,故答案为:BaCO3+2H+=Ba2++CO2↑+H2O;
③滤液D中含有氯离子,与硝酸银溶液的反应是:Ag++Cl-=AgCl↓,故答案为:Ag++Cl-=AgCl↓.
点评:本题是一道关于物质的鉴别题目,注意离子的特征离子反应是解题的关键,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 青花瓷,俗称青花,是中国瓷器的主流品种之一,某同学利用如下方法来粗略测定如图所示的青花瓷瓶的容积.把11.7gNaCl晶体放入到500mL烧杯中,加入500mL蒸镏水,待NaCl完全溶解后,将溶液全部转移到该瓶中,用蒸馏水稀释至完全充满容器(假定溶液浓度均一).从中取出100mL溶液,该溶液恰好能与10mL0.100ml/L的AgNO3溶液完全反应,则下列说法正确的是( )
青花瓷,俗称青花,是中国瓷器的主流品种之一,某同学利用如下方法来粗略测定如图所示的青花瓷瓶的容积.把11.7gNaCl晶体放入到500mL烧杯中,加入500mL蒸镏水,待NaCl完全溶解后,将溶液全部转移到该瓶中,用蒸馏水稀释至完全充满容器(假定溶液浓度均一).从中取出100mL溶液,该溶液恰好能与10mL0.100ml/L的AgNO3溶液完全反应,则下列说法正确的是( )| A、该青花瓷瓶的容积约 20 L |
| B、常温下,该青花瓷瓶几乎能容纳2kg H2O |
| C、常温常压下,该青花瓷瓶几乎能容纳56g N2 |
| D、青花为高级瓷器,该青花瓷瓶可以盛装氢氟酸 |
体积为V mL,密度为ρ g?cm3的溶液,含有摩尔质量为M的溶质m g,其物质的量的浓度为c mol?L-1,溶质的质量分数为w%,则下列表达式正确的是( )
A、c=
| ||
B、m=V?ρ
| ||
C、w%=
| ||
D、c=
|
某同学在做中和热的测定实验时,有些操作不规范,造成测得中和热的数值偏高,请你分析可能的原因( )
| A、测量盐酸的温度后,温度计没有用水冲洗干净 |
| B、把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓 |
| C、量取盐酸时仰视读数 |
| D、将50 mL 0.55 mol/L氢氧化钠溶液取成了50 mL0.55 mol/L的氨水 |
对于某些离子的检验及结论一定正确的是( )
A、加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO
| ||
B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO
| ||
C、加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,不一定有NH
| ||
| D、向待测液中加入KSCN溶液无现象,加入氯水后变为血红色,则待测液中含有Fe2+ |