题目内容
15.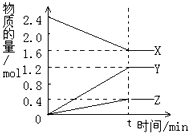 在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.依图所示:
在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图.依图所示:①该反应的化学方程式是2X?3Y+Z.
②反应起始至t分钟,时v(X)正=v(X)逆(填“大于”、“小于”或“等于”),若t=3min,Y的平均反应速率是0.2mol/(L•min).
分析 ①由图象可以看出,反应中X的物质的量减小,Y、Z的物质的量增多,则X为反应物,Y、Z为生成物.t时刻后,X的物质的量为定值且不为零,为可逆反应,且△n(X):△n(Y):△n(Z)=(2.4mol-1.6mol):1.2mol:0.4mol=0.8mol:1.2mol:0.4mol=2:3:1,得到反应的化学方程式;
②X、Y、Z各物质的量不再随时间的变化而变化,说明达到平衡状态,在3min时间内,用Y表示反应的平均速率v=$\frac{△c}{△t}$.
解答 解:①由图象可以看出,反应中X的物质的量减小,Y、Z的物质的量增多,则X为反应物,Y、Z为生成物.t时刻后,X的物质的量为定值且不为零,为可逆反应,且△n(X):△n(Y):△n(Z)=(2.4mol-1.6mol):1.2mol:0.4mol=0.8mol:1.2mol:0.4mol=2:3:1,物质在反应中物质的量之比等于化学方程式计量数之比,则反应的化学方程式为:2X?3Y+Z;
故答案为:2X?3Y+Z;
②反应起始至t分钟时X、Y、Z各物质的量不再随时间的变化而变化,说明达到平衡状态,v(X)正=v(X)逆,若t=3min,Y的平均反应速率=$\frac{\frac{1.2mol}{2L}}{3min}$=0.2mol/(L•min),
故答案为:=;0.2mol/(L•min).
点评 本题考查化学反应速率变化曲线及其应用,涉及化学方程式、平衡状态、反应速率的计算等问题,题目难度不大,注意相关知识的积累.

练习册系列答案
相关题目
6.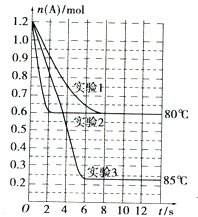 将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)?2B(g).在三种不同条件下进行实验,A的物质的量随时间的变化如图所示.试回答下列问题:
将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)?2B(g).在三种不同条件下进行实验,A的物质的量随时间的变化如图所示.试回答下列问题:
(1)实验1中,4s时A的转化率为37.5%;此条件下该反应的平衡常数K1的值为1.2mol/L.
(2)实验2与实验1对比,其可能隐含的反应条件是使用催化剂.
(3)根据实验3与实验1的图象比较,可推测该反应是吸热(填“放热”或“吸热”)反应.设实验1~3的平衡常数的值分别为K1、K2、K3,则它们之间的关系为K1=K2<K3(填“>”、“<”或“=”).
(4)为了验证增大催化剂的表面积、增大压强可提高化学反应速率这一结论,某同学在实验1的基础上又利用该容器设计了实验4和实验5,部分实验条件及数据见下表.请将表格补充完整
 将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)?2B(g).在三种不同条件下进行实验,A的物质的量随时间的变化如图所示.试回答下列问题:
将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)?2B(g).在三种不同条件下进行实验,A的物质的量随时间的变化如图所示.试回答下列问题:(1)实验1中,4s时A的转化率为37.5%;此条件下该反应的平衡常数K1的值为1.2mol/L.
(2)实验2与实验1对比,其可能隐含的反应条件是使用催化剂.
(3)根据实验3与实验1的图象比较,可推测该反应是吸热(填“放热”或“吸热”)反应.设实验1~3的平衡常数的值分别为K1、K2、K3,则它们之间的关系为K1=K2<K3(填“>”、“<”或“=”).
(4)为了验证增大催化剂的表面积、增大压强可提高化学反应速率这一结论,某同学在实验1的基础上又利用该容器设计了实验4和实验5,部分实验条件及数据见下表.请将表格补充完整
| 实验编号 及其目的 | V(容积)/L | t/℃ | n(A起始)/mol | n(B起始)/mol | 催化剂的质量/g | 催化剂的表面积/m2•g-1[来源:Z.xx.k.Com] |
| 实验1 参照对比实验 | 2 | 80 | 1.2 | 0 | a | b |
| 实验4:催化剂的表面积对反应速率的影响 | | | | | | |
| 实验5目的: | 1 | | | | | |
3. 通过电解饱和食盐水得到的氢氧化钠固体样品常含有氯化钠杂质.来来同学利用中和滴定原理测定氢氧化钠的质量分数.步骤为:
通过电解饱和食盐水得到的氢氧化钠固体样品常含有氯化钠杂质.来来同学利用中和滴定原理测定氢氧化钠的质量分数.步骤为:
①称取15.000g氢氧化钠固体样品,加水溶解,配成200mL溶液;
②用4.80%(密度是1.02g/mL)的盐酸滴定.以下是实验数据记录表:
(1)请根据如图(滴定管局部)读出第2次实验的末读数,填充上表中的两个空格.
(2)计算4.80%(密度是1.02g/mL)盐酸的物质的量浓度(精确至0.0001).
(3)计算氢氧化钠固体样品中氢氧化钠的质量分数.
 通过电解饱和食盐水得到的氢氧化钠固体样品常含有氯化钠杂质.来来同学利用中和滴定原理测定氢氧化钠的质量分数.步骤为:
通过电解饱和食盐水得到的氢氧化钠固体样品常含有氯化钠杂质.来来同学利用中和滴定原理测定氢氧化钠的质量分数.步骤为:①称取15.000g氢氧化钠固体样品,加水溶解,配成200mL溶液;
②用4.80%(密度是1.02g/mL)的盐酸滴定.以下是实验数据记录表:
| 实验序号 | 待测样品溶液体积(mL) | 滴定管读数 | 消耗标准盐酸溶液的体积(mL) | |
| 初读数 | 末读数 | |||
| 1 | 20.00 | 0.00 | 19.95 | 19.95 |
| 2 | 20.00 | 0.05 | 19.90mL | 19.85mL |
(2)计算4.80%(密度是1.02g/mL)盐酸的物质的量浓度(精确至0.0001).
(3)计算氢氧化钠固体样品中氢氧化钠的质量分数.
20.已知空气-锌电池的电极反应为,锌片:Zn+2OH--2e-═ZnO+H2O;碳棒:O2+2H2O+4e-═4OH-,据此判断,锌片是( )
| A. | 正极 被还原 | B. | 正极 被氧化 | C. | 负极 被还原 | D. | 负极 被氧化 |
7.下列离子在溶液中能大量共存的是( )
| A. | Al3+、NO3-、OH-、Cl- | B. | H+、Ba2+、Ag+、Cl- | ||
| C. | Fe2+、Fe3+、Na+、NO3- | D. | Ca2+、H+、Cl-、CO32- |
4.用下列实验装置进行相应实验,能达到实验目的是( )


| A. | 用图甲的方法不能检查此装置的气密性 | |
| B. | 图乙可以作为CCl4萃取溴水后的分液装置 | |
| C. | 实验室用图丙所示装置制取少量氨气 | |
| D. | 图丁洗气瓶中的白色沉淀为BaSO3 |
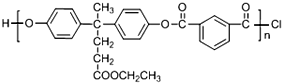
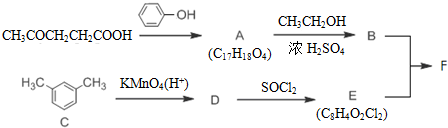
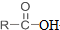 +SOCl2→
+SOCl2→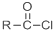 +SO2+HCl
+SO2+HCl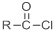 +R′OH→
+R′OH→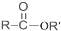 +HCl(R、R′表示烃基)
+HCl(R、R′表示烃基)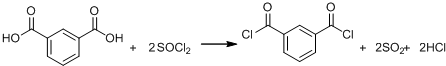 .
.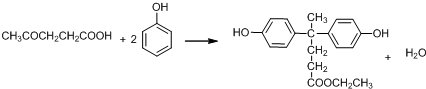 .
.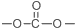 结构.
结构.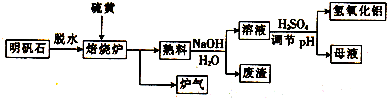
 .
.