题目内容
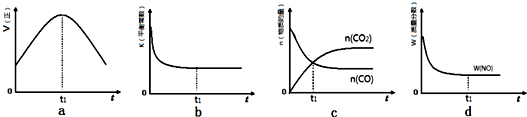
11.可逆反应 N2(g)+3H2(g)?2NH3(g) (正反应为放热反应),将N2和H2按1:4的体积比进行混合,取0.5mol 该混合气体在一定条件下于容积固定的 2L密闭容器中发生反应,2min后,N2 的物质的量变为 0.08mol,反应持续一段时间后,达到平衡状态.当反应达到平衡时容器内的压强为反应前压强的0.88倍.求:(1)2min 时,v(H2)=0.015 mol/(L•min)
(2)达到平衡后,混合气体中氨的物质的量为0.06 mol.
(3)平衡时H2的转化率为22.5%.
(4)工业上合成氨适宜条件是A、C、D
A.温度500℃
B.压强100MPa
C.铁触媒
D.压强20MPa~50MPa.
分析 N2和H2按1:4的体积比进行混合,取0.5mol 该混合气体在一定条件下于容积固定的 2L密闭容器中发生反应,二者的物质的量分别为0.5mol×$\frac{1}{5}$=0.1mol、0.5mol×$\frac{4}{5}$=0.4mol,则
N2(g)+3H2(g)?2NH3(g)
开始 0.1 0.4 0
转化 x 3x 2x
平衡 0.1-x 0.4-3x 2x
到平衡时容器内的压强为反应前压强的0.88倍,则$\frac{0.1-x+0.4-3x+2x}{0.5}$=0.88,解得x=0.03,
(1)结合v=$\frac{△c}{△t}$计算;
(2)由上述分析可知,达到平衡后,混合气体中氨的物质的量为2x;
(3)转化率=$\frac{转化的量}{开始的量}$×100%;
(4)合成氨为放热、且体积减小的反应,结合温度、压强对平衡、速率的影响分析.
解答 解:N2和H2按1:4的体积比进行混合,取0.5mol 该混合气体在一定条件下于容积固定的 2L密闭容器中发生反应,二者的物质的量分别为0.5mol×$\frac{1}{5}$=0.1mol、0.5mol×$\frac{4}{5}$=0.4mol,则
N2(g)+3H2(g)?2NH3(g)
开始 0.1 0.4 0
转化 x 3x 2x
平衡 0.1-x 0.4-3x 2x
到平衡时容器内的压强为反应前压强的0.88倍,则$\frac{0.1-x+0.4-3x+2x}{0.5}$=0.88,解得x=0.03,
(1)2min 时,v(H2)=$\frac{\frac{3×0.03mol}{2L}}{2min}$=0.015mol/(L•min),故答案为:0.015;
(2)达到平衡后,混合气体中氨的物质的量为2×0.03mol=0.06 mol,故答案为:0.06;
(3)平衡时H2的转化率为$\frac{3×0.03}{0.4}$×100%=22.5%,故答案为:22.5%;
(4)工业上合成氨适宜条件是合适的温度、压强、使用催化剂,
A.温度500℃,反应速率及转化率较大,故A选;
B.压强100MPa,对设备的要求较高,故B不选;
C.铁触媒,作催化剂,加快反应速率,故C选;
D.压强20MPa~50MPa,可加快反应速率,利用合成氨,对设备要求不高,故D选;
故答案为:A、C、D.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、速率及转化率计算为解答的关键,侧重分析与计算能力的考查,注意合成氨条件的选择与工业生产的关系,题目难度中等.

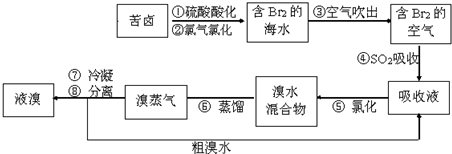
| A. | 步骤④⑤是为了富集溴 | |
| B. | 步骤③说明溴具有挥发性 | |
| C. | 步骤④的离子方程式为Br2+SO2+H2O═2H++2Br-+SO32- | |
| D. | 步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物可用分液漏斗分离 |
(1)治理尾气中NO和CO的一种方法是:在汽车排气管上装一个催化转化装置,使二者发生反应转化成无毒无污染气体,该反应的化学方程式是2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2.
(2)活性炭也可用于处理汽车尾气中的NO.在1L恒容密闭容器中加入0.1000mol NO和2.030mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量以及容器内压强如下表:
| 活性炭/mol | NO/mol | A/mol | B/mol | p/MPa | |
| 200℃ | 2.00 | 0.0400 | 0.0300 | 0.0300 | 3.93 |
| 335℃ | 2.005 | 0.050 | 0.0250 | 0.0250 | p |
(3)汽车尾气中的SO2可用石灰水来吸收,生成亚硫酸钙浊液.常温下,测得某纯CaSO3与水形成的浊液pH为9,已知Kal(H2SO3)=1.8×10-2,Ka2(H2SO3)=6.0×10-9,忽略SO32-的第二步水解,则Ksp(CaSO3)=4.2×10-9.
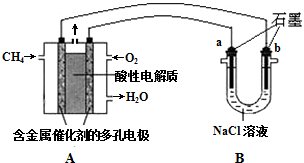
(4)尾气中的碳氢化合物含有甲烷,其在排气管的催化转化器中可发生如下反应CH4(g)+H20(1)?CO(g)+3H2 (g)△H=+250.1kJ•mol-l.已知CO(g)、H2(g)的燃烧热依次为283.0kJ•mol-1、285.8kJmol-1,请写出表示甲烷燃烧热的热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ/mol.以CH4(g)为燃料可以设计甲烷燃料电池,该电池以稀H2S04作电解质溶液,其负极电极反应式为CH4-8e-+2H2O=CO2+8H+,已知该电池的能量转换效率为86.4%,则该电池的比能量为13.4kW•h•kg-1(结果保留1位小数,比能量=$\frac{电池输出电能(kW•h)}{燃料质量(kg)}$,lkW•h=3.6×1 06J).
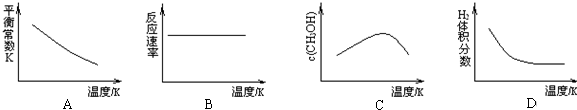
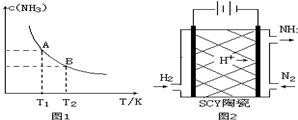
①当温度由T1变化到T2时,平衡常数关系K1>K2(填“>”,“<”或“=”),焓变△H<0.(填“>”或“<”)
②该反应在T1温度下5.00min达到平衡,这段时间内N2的化学反应速率为8.00×10-3mol/(L•min).
③T1温度下该反应的化学平衡常数K1=18.3.
(2)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g),此反应的△S>0(填“>”或“<”).
若已知:N2(g)+3H2(g)=2NH3(g)△H=a kJ/mol
2H2(g)+O2(g)=2H2O(l)△H=b kJ/mol
2N2(g)+6H2O(l)=4NH3(g)+3O2(g)的△H=(2a-3b)kJ/mol(用含a、b的式子表示).
(3)科学家采用质子高导电性的SCY陶瓷(可传递H+)实现了低温常压下高转化率的电化学合成氨,其实验原理示意图如图2所示,则阴极的电极反应式是N2+6e-+6H+=2NH3.
(4)已知某些弱电解质在水中的电离平衡常数(25℃)如表:
| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
①该溶液呈性(填“酸”、“中”、“碱”),原因是由于NH3•H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液呈碱性.
②该(NH4)2CO3溶液中各微粒浓度之间的关系式不正确的是B.
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3•H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1
D.c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
| A. | CuSO4只做还原剂 | |
| B. | 10mol CuSO4可氧化P的物质的量为2mol | |
| C. | Cu3P既是氧化产物,又是还原产物 | |
| D. | 生成1mol Cu3P时,被氧化的P的物质的量为2.2mol |
| A. | 松花蛋 | B. | 纯净水 | C. | 可乐 | D. | 馒头 |