题目内容
17.下列化学性质中,苯不具备的是( )| A. | 可以在空气中燃烧 | B. | 与Br2发生取代反应 | ||
| C. | 与H2发生加成反应 | D. | 能使高锰酸钾溶液褪色 |
分析 苯性质稳定,可发生取代、加成反应,难以氧化,可燃烧,以此解答该题.
解答 解:A.苯为烃类物质,可燃烧生成二氧化碳和水,故A正确;
B.在催化条件下,可与溴发生取代反应生成溴苯,故B正确;
C.在催化条件下可与氢气发生加成反应生成环己烷,故C正确;
D.性质稳定,与高锰酸钾不反应,故D错误.
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的组成、官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
5. 某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
已知: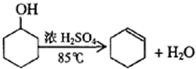
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入l mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.A中碎瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上层(填上或下),分液后用b (填入编号)洗涤.
a.KMnO4溶液 b.Na2CO3溶液 c.稀H2SO4
②收集产品时,控制的温度应在83℃左右.
(3)以下区分环己烯精品和粗品的方法,合理的是bc.
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点.
 某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯已知:

| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
将12.5mL环己醇加入试管A中,再加入l mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.A中碎瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上层(填上或下),分液后用b (填入编号)洗涤.
a.KMnO4溶液 b.Na2CO3溶液 c.稀H2SO4
②收集产品时,控制的温度应在83℃左右.
(3)以下区分环己烯精品和粗品的方法,合理的是bc.
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点.
2.对于反应X(g)+Y(g)?3Z(g)(正反应为吸热反应),下列可作为平衡状态的标志的是( )
①单位时间内,A、B生成C的分子数与分解C的分子数相等
②体系的温度不再变化
③外界条件不变时,A、B的浓度不随时间而变化
④体系的压强不再变化
⑤体系的分子总数不再变化.
①单位时间内,A、B生成C的分子数与分解C的分子数相等
②体系的温度不再变化
③外界条件不变时,A、B的浓度不随时间而变化
④体系的压强不再变化
⑤体系的分子总数不再变化.
| A. | ①③⑤ | B. | ②③④ | C. | ①③④⑤ | D. | ①②③④⑤ |
6.下列物质不能和NaOH发生反应的是( )
| A. | 阿司匹林 | B. | 醋酸 | C. | 小苏打 | D. | 苏打 |
7.下列说法正确的是( )
| A. |  =KCl+3Cl2↑+3H2O =KCl+3Cl2↑+3H2O | |
| B. | H2S+H2SO4(浓)═S↓+SO2↑+2H2O | |
| C. | 2H2S+SO2═3S↓+2H2O中氧化剂与还原剂的物质的量之比是1:2 | |
| D. | 3NO2+H2O═2HNO3+NO中氧化剂与还原剂的物质的量之比是1:1 |


 实验室配制500mL、0.2mol/L的Na2SO4溶液,实验操作步骤有:
实验室配制500mL、0.2mol/L的Na2SO4溶液,实验操作步骤有: