题目内容
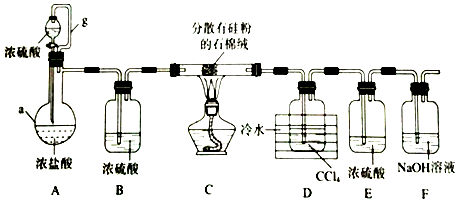
12.高锰酸钾在实验室和工农业生产中有广泛的用途.实验室以二氧化锰为主要原料制备高锰酸钾.其部分流程如下:
(1)第①步加热熔融应在铁坩埚中进行.而不用瓷坩埚的原因是SiO2+2KOH$\frac{\underline{\;\;△\;\;}}{\;}$K2SiO3+H2O(用化学程式表示).
(2)第④步通入CO2,可以使Mn片发生反应.生成MnO4-和MnO2.反应的离子方程式为3MnO42-+2CO2=2MnO4-+MnO2↓+2CO32-.则完成反应时,转化为KMnO4的占全部K2MnO4的百分率约为66.7%(精确到0.1%).
(3)第⑤步趁热过滤的是减少过滤的损耗.
(4)第⑥步加热浓缩至液面有细小晶体析出时.停止加热.冷却结晶、过滤、洗涤、干燥.干燥过程中.温度不宜过高.其原因是2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑(用化学方程式表示).
(5)H2O2和KMnO4,都是常用的强氧化剂.若向H2O2溶液中滴加酸性高锰酸钾溶液.则酸性高锰酸钾溶液会褪色.写出该反应的离子方程式:2MnO4-+6H++5H2O2=2Mn2++8H2O+5O2↑.该反应说明H2O2的氧化性比KMnO4弱(填“强”或“弱”).
分析 在碱性条件下氯酸钾与二氧化锰加热熔融发生氧化还原反应,二氧化锰被氧化成锰酸钾,溶于水得墨绿色K2MnO4溶液,K2MnO4溶液中通入CO2使MnO42-发生歧化反应,生成MnO4-和MnO2,趁热过滤除去二氧化锰,得高锰酸钾溶液,冷却结晶得高锰酸钾晶体,
(1)熔融固体需要用铁坩埚熔融,瓷坩埚原料含有SiO2,能和碱反应,高温下与KOH发生反应;
(2)由题意可知,KOH、KClO3、MnO2共熔制得绿色K2MnO4;CO2使MnO42-发生歧化反应,生成MnO4-和MnO2,反应中MnO42-→MnO4-,Mn元素化合价由+6价升高为+7,化合价总共升高1价,MnO42-→MnO2,Mn元素化合价由+6价降低为+4,化合价总共降低2价,化合价升高最小公倍数为2,故MnO4-系数为2,MnO2系数为1,根据锰元素守恒可知,转化KMnO4的MnO42-占$\frac{2}{3}$;
(3)趁热过滤的目的是为了减少过滤损失;
(4)KMnO4在加热的条件下会发生分解反应;
(5)向H2O2溶液中滴加酸性高锰酸钾溶液.则酸性高锰酸钾溶液会褪色说明高锰酸钾做氧化剂氧化过氧化氢为氧气,依据电子守恒和原子守恒分析配平书写离子方程式;依据氧化还原反应中氧化剂的氧化性大于反应中其他物质分析判断.
解答 解:(1)熔融固体需要用铁坩埚熔融,瓷坩埚原料含有SiO2,在高温下,瓷坩埚可以和KOH发生反应SiO2+2KOH$\frac{\underline{\;\;△\;\;}}{\;}$K2SiO3+H2O,腐蚀瓷坩埚,故不能使用瓷坩埚,而使用铁坩埚,
故答案为:铁坩埚;SiO2+2KOH$\frac{\underline{\;\;△\;\;}}{\;}$K2SiO3+H2O;
(2)由题意可知,KOH、KClO3、MnO2共熔制得绿色K2MnO4,根据氧化还原反应可知,还生成KCl,由元素守恒可知,还会生成H2O,反应方程式为KClO3+3MnO2+6KOH $\frac{\underline{\;熔融\;}}{\;}$KCl+3K2MnO4+3H2O;CO2使MnO42-发生歧化反应,生成MnO4-和MnO2,反应的离子方程式为:3MnO42-+2CO2=2MnO4-+MnO2↓+2CO32-;反应中MnO42-→MnO4-,Mn元素化合价由+6价升高为+7,化合价总共升高1价,MnO42-→MnO2,Mn元素化合价由+6价降低为+4,化合价总共降低2价,化合价升高最小公倍数为2,故MnO4-系数为2,MnO2系数为1,根据锰元素守恒MnO42-系数为3,所以转化KMnO4的MnO42-占$\frac{2}{3}$,故K2MnO4完全反应时转化为KMnO4的百分率约$\frac{2}{3}$×100%=66.7%,
故答案为:3MnO42-+2CO2=2MnO4-+MnO2↓+2CO32-;66.7%;
(3)步骤⑤趁热过滤的目的是防止降温过程中KMnO4析出而损耗,减少过滤过程中晶体析出损耗,
故答案为:减少过滤的损耗;
(4)第⑥步加热浓缩至液面有细小晶体析出时,停止加热,冷却结晶,过滤,洗涤,干燥,KMnO4在温度过高的条件下会发生分解反应,反应化学方程式为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,故在加热、浓缩、烘干的过程中温度不宜过高,
故答案为:过滤;2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(5)向H2O2溶液中滴加酸性高锰酸钾溶液.则酸性高锰酸钾溶液会褪色说明高锰酸钾做氧化剂氧化过氧化氢为氧气,反应的离子方程式为:2MnO4-+6H++5H2O2=2Mn2++8H2O+5O2↑;反应中表面高锰酸钾的氧化性大于过氧化氢,
故答案为:2MnO4-+6H++5H2O2=2Mn2++8H2O+5O2↑;弱.
点评 本题考查学生对工艺流程的理解、阅读获取信息能力、物质推断、氧化还原反应、工艺条件的控制等,题目难度中等,是对所学知识的综合运用与能力的考查,需要学生具备扎实的基础知识与综合运用知识、信息进行解决问题的能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 90% | B. | 80% | C. | 45% | D. | 10% |
| A. | 可以在空气中燃烧 | B. | 与Br2发生取代反应 | ||
| C. | 与H2发生加成反应 | D. | 能使高锰酸钾溶液褪色 |

 亚磷酸二乙酯[HPO(OC2H5)2]为重要的阻燃增塑剂,实验室采用三氯化磷和无水乙醇制备亚磷酸二乙酯:PCl3+4C2H5OH→HPO(OC2H5)2+HCl↑+2C2H5Cl+H2O;实验步骤如下:
亚磷酸二乙酯[HPO(OC2H5)2]为重要的阻燃增塑剂,实验室采用三氯化磷和无水乙醇制备亚磷酸二乙酯:PCl3+4C2H5OH→HPO(OC2H5)2+HCl↑+2C2H5Cl+H2O;实验步骤如下: