题目内容
10.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )| A. | 12g金刚石含有的共价键数为4NA | |
| B. | 1.00molNaCl中约含有6.02×1023个NaCl分子 | |
| C. | 常温下,23g NO2和N2O4的混合物含有1.5NA个原子 | |
| D. | agC2H4和C3H6的混合物所含共用电子对数目为($\frac{a}{7}$+1)NA |
分析 A、求出金刚石的物质的量,然后根据1mol金刚石中含2mol共价键来分析;
B、氯化钠为离子晶体;
C、NO2和N2O4的最简式均为NO2;
D、C2H4和C3H6的最简式均为CH2,且1molCH2中3mol共用电子对来分析.
解答 解:A、12g金刚石的物质的量为1mol,而1mol金刚石中含2mol共价键,故为2NA,故A错误;
B、氯化钠为离子晶体,故氯化钠固体中无氯化钠分子,故B错误;
C、NO2和N2O4的最简式均为NO2,故23g混合物中含有的NO2的物质的量为0.5mol,故含1.5NA个原子,故C正确;
D、C2H4和C3H6的最简式均为CH2,故ag混合物中含有的CH2的物质的量为$\frac{a}{14}$mol,而1molCH2中3mol共用电子对,故$\frac{a}{14}$molCH2中含有$\frac{3a}{14}$NA条共价键,故D 错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
1.若用乙烯和氯气在适当的条件下反应制取四氯乙烷,这一过程中所发生的反应类型及耗用氯气的总的物质的量是(设乙烯为1mol,反应产物中的有机物只有四氯乙烷)( )
| A. | 取代,4 mol Cl2 | B. | 加成、取代,3 mol Cl2 | ||
| C. | 加成,2 mol Cl2 | D. | 加成、取代,5 mol Cl2 |
5.为证明化学反应有一定的限度,进行如下探究活动:I.取5m1 0.1mol/L的KI溶液,滴加几滴FeCl3稀溶液(已知:2Fe3++2I-=I2+2Fe2+)Ⅱ.继续加入2ml CCl4振荡.Ⅲ.取萃取后的上层清液,滴加KSCN溶液.
(1)探究活动I的实验现象为溶液呈棕黄色;探究活动Ⅱ的实验现象为溶液分层,下层CCl4层呈紫红色.
(2)探究活动Ⅲ的意图是通过生成血红色的Fe(SCN)3溶液,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈血红色.对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+;
猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察.
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大,Fe(SCN)3在乙醚中与在水中呈现的颜色相同;
信息二:Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6](黄色)溶液检验Fe3+的灵敏度比用KSCN更高.结合新信息,现设计以下实验方案验证猜想:
ⅰ.请完成下表实验操作、现象和结论
ⅱ.写出实验操作“步骤一”中反应的离子方程式为4Fe3++3[Fe(CN)6]4-═Fe4[Fe(CN)6]3↓..
(1)探究活动I的实验现象为溶液呈棕黄色;探究活动Ⅱ的实验现象为溶液分层,下层CCl4层呈紫红色.
(2)探究活动Ⅲ的意图是通过生成血红色的Fe(SCN)3溶液,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈血红色.对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+;
猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察.
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大,Fe(SCN)3在乙醚中与在水中呈现的颜色相同;
信息二:Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6](黄色)溶液检验Fe3+的灵敏度比用KSCN更高.结合新信息,现设计以下实验方案验证猜想:
ⅰ.请完成下表实验操作、现象和结论
| 实 验 操 作 | 现 象 和 结 论 |
| 步骤一:取萃取后的上层清液滴加2滴K4[Fe(CN)6] | 若产生①蓝色沉淀, 则②猜想一不成立; |
| 步骤二:往探究Ⅲ所得溶液中加入少量乙醚,充分振荡、静置分层 | 若③乙醚层呈血红色, 则④猜想二成立; |
15.下列指定反应的离子方程式正确的是( )
| A. | 碳酸钠的水解:CO32-+2H2O?H2CO3+2OH- | |
| B. | 钠和CuSO4溶液反应:2Na+Cu2+═Cu+2Na+ | |
| C. | 用食醋溶解水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- |
2.下列文字表述与反应方程式对应,且正确的是( )
| A. | 用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| B. | 利用腐蚀法制作印刷线路板:Fe3++Cu=Fe2++Cu2+ | |
| C. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓ | |
| D. | 用液溴和苯在催化剂作用下制溴苯: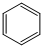 +Br2$\stackrel{催化剂}{→}$ +Br2$\stackrel{催化剂}{→}$ +HBr +HBr |
19.在T℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g•cm-3,溶质的质量分数为w,其中含NH4+ 的物质的量为b mol.下列叙述中正确的是( )
| A. | 溶质的质量分数为w=$\frac{a}{Vρ-a}$×100% | |
| B. | 溶质的物质的量浓度c=$\frac{1000a}{17V}$ mol•L-1 | |
| C. | 上述溶液中再加入相同质量的水后,所得溶液的物质的量浓度变为原来一半 | |
| D. | 上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w |
13.碳纳米管是由石墨的一层网状结构卷曲成的单层或多层的管状结构,是继C60发现以后的又一种热点材料,下列叙述不正确的是( )
| A. | 碳纳米管和C60都是单质 | |
| B. | 碳纳米管和金刚石的结构和性质相同 | |
| C. | 碳纳米管和石墨互为同素异形体 | |
| D. | 碳纳米管也能在空气中燃烧生成二氧化碳 |

 、
、 、其最高价氧化物对应的水化物的化学式H3PO4、其气态氢化物的分子空间构型为三角锥形.
、其最高价氧化物对应的水化物的化学式H3PO4、其气态氢化物的分子空间构型为三角锥形.