题目内容
标准状况下,44.8L HCl气体溶于492mL水配制成溶液,所得溶液密度为1.13g/cm3.
(1)求所得盐酸的物质的量浓度?
(2)若将此溶液再稀释成1L溶液,求稀释后盐酸的物质的量浓度?
(1)求所得盐酸的物质的量浓度?
(2)若将此溶液再稀释成1L溶液,求稀释后盐酸的物质的量浓度?
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:标况下,n(HCl)=
=2mol,m(HCl)=2mol×36.5g/mol=73g,水的质量为492g,溶液体积=
=0.5L,
(1)根据C=
计算盐酸的物质的量浓度;
(2)稀释前后溶质的物质的量不变,据此计算稀释后溶液物质的量浓度.
| 44.8L |
| 22.4L/mol |
| 73g+492g |
| 1.13×103g/L |
(1)根据C=
| n |
| V |
(2)稀释前后溶质的物质的量不变,据此计算稀释后溶液物质的量浓度.
解答:
解:标况下,n(HCl)=
=2mol,m(HCl)=2mol×36.5g/mol=73g,水的质量为492g,溶液体积=
=0.5L,
(1)盐酸物质的量浓度C=
=
=4mol/L,答:盐酸物质的量浓度为4mol/L;
(2)稀释前后溶质的物质的量不变,根据n=CV知,溶液体积增大2倍,则盐酸物质的量浓度为原来的一半,所以稀释后溶液浓度=
×4mol/L=2mol/L,答:稀释后溶液浓度为2mol/L.
| 44.8L |
| 22.4L/mol |
| 73g+492g |
| 1.13×103g/L |
(1)盐酸物质的量浓度C=
| n |
| V |
| 2mol |
| 0.5L |
(2)稀释前后溶质的物质的量不变,根据n=CV知,溶液体积增大2倍,则盐酸物质的量浓度为原来的一半,所以稀释后溶液浓度=
| 1 |
| 2 |
点评:本题考查物质的量浓度计算,根据公式C=
、n=CV分析解答即可,注意计算溶液体积时要进行单位换算,知道mL、L之间的进制是1000,为易错点.
| n |
| V |

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案
相关题目
CS2是一种有恶臭的液体,它滴入用H2SO4酸化的KMnO4溶液时,有黄色沉淀析出,并放出CO2气体.当产生0.5mol CO2时,转移的电子数目是( )
| A、NA |
| B、2NA |
| C、3NA |
| D、4NA |
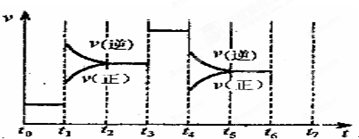
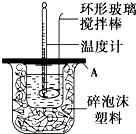 分别取40mL的0.50mol/L盐酸与0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题:
分别取40mL的0.50mol/L盐酸与0.55mol/L氢氧化钠溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.请回答下列问题:
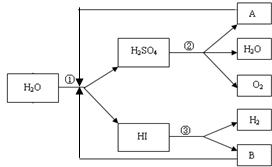 人类研究氢能源从未间断过,而热化学循环分解水制氢气是在水反应体系中加入一种中间物,经历不同的反应阶段,最终将水分解为氢气和氧气,这是一种节约能源、节省反应物料的技术,如图是一个热化学循环制氢气法的流程:
人类研究氢能源从未间断过,而热化学循环分解水制氢气是在水反应体系中加入一种中间物,经历不同的反应阶段,最终将水分解为氢气和氧气,这是一种节约能源、节省反应物料的技术,如图是一个热化学循环制氢气法的流程: 实验室用氯化钠固体配制1.00mol/L的NaCl溶液0.5L,回答下列问题
实验室用氯化钠固体配制1.00mol/L的NaCl溶液0.5L,回答下列问题