题目内容
(1)以CO2为碳源制取低碳有机物一直是化学领域的研究热点,CO2加氢制取低碳醇的反应如下:
反应Ⅰ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.0kJ/mol
反应Ⅱ:2CO2(g)+6H2(g)=CH3CH2OH(g)+3H2O(g)△H=-173.6kJ/mol
写出由CH3OH(g)合成CH3CH2OH(g)的反应的热化学方程式 .
(2)高铁酸钾(K2FeO4)是铁的一种重要化合物,具有极强的氧化性
①电解法是工业上制备K2FeO4的一种方法.以铁为阳极电解氢氧化钠溶液,然后在阳极溶液中加入KOH.电解时阳极发生反应生成FeO42-,该电极反应式为 .
②与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作正极材料,其电极反应式为FeO42-+3e-+4H2O=Fe(OH)3+5OH-,则该电池总反应的离子方程式为 .
(3)a mol FeS与b mol FeO投入到VL、c mol/L的硝酸溶液中充分反应产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为 .
①(a+b)×63g; ②(a+b)×189g; ③(a+b)mol; ④VC-
mol.
反应Ⅰ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.0kJ/mol
反应Ⅱ:2CO2(g)+6H2(g)=CH3CH2OH(g)+3H2O(g)△H=-173.6kJ/mol
写出由CH3OH(g)合成CH3CH2OH(g)的反应的热化学方程式
(2)高铁酸钾(K2FeO4)是铁的一种重要化合物,具有极强的氧化性
①电解法是工业上制备K2FeO4的一种方法.以铁为阳极电解氢氧化钠溶液,然后在阳极溶液中加入KOH.电解时阳极发生反应生成FeO42-,该电极反应式为
②与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作正极材料,其电极反应式为FeO42-+3e-+4H2O=Fe(OH)3+5OH-,则该电池总反应的离子方程式为
(3)a mol FeS与b mol FeO投入到VL、c mol/L的硝酸溶液中充分反应产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
①(a+b)×63g; ②(a+b)×189g; ③(a+b)mol; ④VC-
| 9a+b |
| 3 |
考点:热化学方程式,化学方程式的有关计算,电解原理
专题:计算题,化学反应中的能量变化,电化学专题
分析:(1)依据热化学方程式和盖斯定律计算得到;
(2)①电解时阳极发生反应生成FeO42-,依据化合价的变化和电荷守恒书写电极反应;
②原电池的负极发生氧化反应,正极电极反应式为:①FeO42-+3eˉ+4H2O→Fe(OH)3+5OHˉ;负极电极反应为:②Zn-2e-+2OH-=Zn(OH)2;依据电极反应的电子守恒,①×2+②×3合并得到电池反应为:3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OHˉ;
(3)分情况讨论:
1)当硝酸恰好反应时,生成硝酸铁的硝酸就是未被还原的硝酸,根据铁离子的物质的量计算未被还原的硝酸的物质的量即可.
2)当硝酸过量时,除去生成一氧化氮的硝酸就是未被还原的硝酸,根据氧化还原反应中得失电子守恒计算被还原的硝酸,硝酸总量-被还原的硝酸=未被还原的硝酸.
(2)①电解时阳极发生反应生成FeO42-,依据化合价的变化和电荷守恒书写电极反应;
②原电池的负极发生氧化反应,正极电极反应式为:①FeO42-+3eˉ+4H2O→Fe(OH)3+5OHˉ;负极电极反应为:②Zn-2e-+2OH-=Zn(OH)2;依据电极反应的电子守恒,①×2+②×3合并得到电池反应为:3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OHˉ;
(3)分情况讨论:
1)当硝酸恰好反应时,生成硝酸铁的硝酸就是未被还原的硝酸,根据铁离子的物质的量计算未被还原的硝酸的物质的量即可.
2)当硝酸过量时,除去生成一氧化氮的硝酸就是未被还原的硝酸,根据氧化还原反应中得失电子守恒计算被还原的硝酸,硝酸总量-被还原的硝酸=未被还原的硝酸.
解答:
解:(1)已知:反应I:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0 kJ?mol-1
反应II:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=-173.6kJ?mol-1
根据盖斯定律Ⅱ-I×2得:2CH3OH(g)=CH3CH2OH(g)+H2O(g);△H=-75.6 kJ?mol-1;
故答案为:2CH3OH(g)=CH3CH2OH(g)+H2O(g)△H=-75.6 kJ?mol-1;
(2)①阳极是铁失电子在碱性溶液中发生氧化反应生成FeO42-;电极反应为:Fe+8OHˉ-6eˉ=FeO42-+4H2O;
故答案为:Fe+8OHˉ-6eˉ=FeO42-+4H2O;
②原电池的负极发生氧化反应,正极电极反应式为:①FeO42-+3eˉ+4H2O→Fe(OH)3+5OHˉ;负极电极反应为:②Zn-2e-+2OH-=Zn(OH)2;依据电极反应的电子守恒,①×2+②×3合并得到电池反应为:3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OHˉ;
故答案为:3Zn+2FeO42-+8H2O=2Fe(OH)3+3Zn(OH)2+4OH-;
(3)分情况讨论:
1)当硝酸恰好反应时,amolFeS与bmolFeO被氧化生成Fe(NO3)3,根据铁原子守恒找出铁原子和硝酸的关系式:
amolFeS+bmolFeO→(amol+bmol)Fe→(amol+bmol)Fe(NO3)3→3(amol+bmol)HNO3,所以未被还原的硝酸的质量=3(amol+bmol)×63g/mol=(a+b)×189g,故②正确.
2)当硝酸过量时,amolFeS与bmolFeO生成Fe(NO3)3和H2SO4失去的电子数=amol[(3-2)+(6-(-2))]+bmol(3-2)=(9a+b)mol,氧化还原反应中得失电子数相等,所以硝酸得到(9a+b)mol电子生成一氧化氮,一个硝酸分子得到3个电子生成NO,所以被还原的硝酸的物质的量=
mol,未被还原的硝酸的物质的量=(Vc-
)mol,故④正确.
故选②④.
反应II:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=-173.6kJ?mol-1
根据盖斯定律Ⅱ-I×2得:2CH3OH(g)=CH3CH2OH(g)+H2O(g);△H=-75.6 kJ?mol-1;
故答案为:2CH3OH(g)=CH3CH2OH(g)+H2O(g)△H=-75.6 kJ?mol-1;
(2)①阳极是铁失电子在碱性溶液中发生氧化反应生成FeO42-;电极反应为:Fe+8OHˉ-6eˉ=FeO42-+4H2O;
故答案为:Fe+8OHˉ-6eˉ=FeO42-+4H2O;
②原电池的负极发生氧化反应,正极电极反应式为:①FeO42-+3eˉ+4H2O→Fe(OH)3+5OHˉ;负极电极反应为:②Zn-2e-+2OH-=Zn(OH)2;依据电极反应的电子守恒,①×2+②×3合并得到电池反应为:3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OHˉ;
故答案为:3Zn+2FeO42-+8H2O=2Fe(OH)3+3Zn(OH)2+4OH-;
(3)分情况讨论:
1)当硝酸恰好反应时,amolFeS与bmolFeO被氧化生成Fe(NO3)3,根据铁原子守恒找出铁原子和硝酸的关系式:
amolFeS+bmolFeO→(amol+bmol)Fe→(amol+bmol)Fe(NO3)3→3(amol+bmol)HNO3,所以未被还原的硝酸的质量=3(amol+bmol)×63g/mol=(a+b)×189g,故②正确.
2)当硝酸过量时,amolFeS与bmolFeO生成Fe(NO3)3和H2SO4失去的电子数=amol[(3-2)+(6-(-2))]+bmol(3-2)=(9a+b)mol,氧化还原反应中得失电子数相等,所以硝酸得到(9a+b)mol电子生成一氧化氮,一个硝酸分子得到3个电子生成NO,所以被还原的硝酸的物质的量=
| 9a+b |
| 3 |
| 9a+b |
| 3 |
故选②④.
点评:本题考查学生阅读题目获取信息的能力、电解原理的应用,原电池的工作原理的应用,电极反应,电极产物的判断等,难度中等,要求学生要有扎实的基础知识和灵活运用知识解决问题的能力,注意基础知识的全面掌握.

练习册系列答案
相关题目
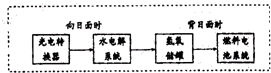 “神七”登天标志着我国的航天事业进入了新的篇章.
“神七”登天标志着我国的航天事业进入了新的篇章.
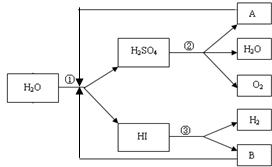 人类研究氢能源从未间断过,而热化学循环分解水制氢气是在水反应体系中加入一种中间物,经历不同的反应阶段,最终将水分解为氢气和氧气,这是一种节约能源、节省反应物料的技术,如图是一个热化学循环制氢气法的流程:
人类研究氢能源从未间断过,而热化学循环分解水制氢气是在水反应体系中加入一种中间物,经历不同的反应阶段,最终将水分解为氢气和氧气,这是一种节约能源、节省反应物料的技术,如图是一个热化学循环制氢气法的流程:
 实验室用氯化钠固体配制1.00mol/L的NaCl溶液0.5L,回答下列问题
实验室用氯化钠固体配制1.00mol/L的NaCl溶液0.5L,回答下列问题