题目内容
3.Ⅰ.某反应体系中的物质有:KOH、MnO2、KCl、KClO3、K2MnO4.(1)请将剩余的生成物填在[]内,并配平(系数填在横线内).
3MnO2+6KOH+1 KClO3═3 K2MnO4+1KCl+3[H2O]
(2)在上述反应中,做还原剂的物质是MnO2;还原产物是KCl.
Ⅱ.实验室可用KClO3与浓盐酸来制取氯气,还可生成KCl,该反应在常温下即可发生.试写出反应的化学方程式:KClO3+6HCl═3Cl2+KCl+3H2O;
比较KClO3与MnO2氧化性的强弱:KClO3的氧化性强于(填“强于”“弱于”)MnO2.
分析 Ⅰ.(1)反应中,Mn元素的化合价由+4价升高为+6价,Cl元素的化合价由+5价降低为-1价,依据氧化还原反应得失电子守恒及原子个数守恒定律配平方程式;
(2)所含元素化合价升高的反应物为还原剂,对应氧化产物;所含元素化合价降低的反应物为氧化剂,对应还原产物;
Ⅱ.氯酸钾与浓盐酸反应生成氯化钾、氯气和水,据此写出反应的化学方程式;
依据同一个氧化还原反应中氧化剂氧化性大于还原剂氧化性解答.
解答 Ⅰ.(1)MnO2+KOH+KClO3→K2MnO4+KCl+H2O中,Mn元素的化合价由+4价升高为+6价,Cl元素的化合价由+5价降低为-1价,由氧化还原反应得失电子守恒及原子个数守恒定律可知,反应的方程式为:3MnO2+6KOH+KClO3=3K2MnO4+KCl+3H2O,
故答案为:3、6、1、3、1、3H2O;
(2)3MnO2+6KOH+KClO3=3K2MnO4+KCl+3H2O,反应物MnO2中锰元素化合价升高,所以MnO2为还原剂,对应K2MnO4为氧化产物;反应物KClO3中锰氯素化合价降低,所以KClO3为氧化剂,对应KCl为还原产物;
故答案为:MnO2;KCl;
Ⅱ.在常温下也能产生Cl2,氯酸钾中+5价的氯元素转化成0价的氯气,HCl中-1价的氯元素转化成0价,化合价变化的最小公倍数为5,则氯酸钾的系数为1、被氧化的HCl的系数为5,再利用质量守恒定律配平可得该反应的化学方程式为:KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O,
故答案为:KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O;
依据方程式:3MnO2+6KOH+KClO3=3K2MnO4+KCl+3H2O可知,二氧化锰为还原剂,氯酸钾为氧化剂,则氧化性强弱顺序为:KClO3的氧化性强于MnO2;
故答案为:强于.
点评 本题考查了氧化还原反应相关知识,涉及氧化还原反应方程式的配平,氧化还原反应基本概念判断,氧化性强弱判断,题目难度不大.

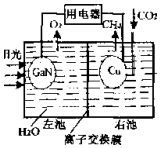 太阳能光电池由于具有可靠性好、寿命长等特点,适于很多特蛛环境和场合,现已得到广泛应用.氮化镓(GaN)光电池的结构如图所示.下列说法中正确的是( )
太阳能光电池由于具有可靠性好、寿命长等特点,适于很多特蛛环境和场合,现已得到广泛应用.氮化镓(GaN)光电池的结构如图所示.下列说法中正确的是( )| A. | 该装置系统中只存在两种能量转化 | |
| B. | Cu电极上的电极反应为:CO2+8e-+8H+═CH4+2H2O | |
| C. | 离子交换膜为质子交换膜,H+从右池移向左池 | |
| D. | 常温下,当装置中有1mol CH4生成时,GaN电极有 44.8LO2生成(不考虑O2的溶解性) |
| A. | NaCl | B. | MgCl2 | C. | AlC13 | D. | FcC12 |
| A | B | C | D |
 |  |  |  |
| 用灼烧法可鉴别毛笔羊毫的真伪 | 用墨写字画画可长久不褪色 | 纸及造纸原料的主要成分均是纤维素 | 用石材制作砚台的过程是化学变化 |
| A. | A | B. | B | C. | C | D. | D |