题目内容
18.38.4g铜与适量浓硝酸恰好完全反应,共收集到17.92L(标准状况)气体,通过计算说明气体的成分和物质的量.分析 n(Cu)=$\frac{38.4g}{64g/mol}$=0.6mol,Cu与浓硝酸反应生成氮的氧化物,n(气体)=$\frac{17.92L}{22.4L/mol}$=0.8mol,结合电子、原子守恒计算.
解答 解:n(Cu)=$\frac{38.4g}{64g/mol}$=0.6mol,n(气体)=$\frac{17.92L}{22.4L/mol}$=0.8mol,
设生成气体NO2、NO的物质的量分别为x、y,
由电子及原子守恒可知,
$\left\{\begin{array}{l}{x+3y=0.6×2}\\{x+y=0.8}\end{array}\right.$
解得x=0.6mol、y=0.2mol,
答:气体的成分为NO2、NO,物质的量分别为0.6mol、0.2mol.
点评 本题考查氧化还原反应的计算,为高频考点,把握电子及原子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法的应用,题目难度不大.

练习册系列答案
相关题目
8.某同学用某种粗盐进行提纯实验,步骤如图.

请回答:
(1)步骤①和②的操作相同,其名称是过滤.
(2)步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止局部过热,造成固体(或溶液)飞溅,当蒸发皿中有较多量固体出现时,应停止加热(或熄灭酒精灯),用余热使水分蒸干.
(3)猜想和验证,补充完整相应的操作、现象和结论:

请回答:
(1)步骤①和②的操作相同,其名称是过滤.
(2)步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止局部过热,造成固体(或溶液)飞溅,当蒸发皿中有较多量固体出现时,应停止加热(或熄灭酒精灯),用余热使水分蒸干.
(3)猜想和验证,补充完整相应的操作、现象和结论:
| 猜想 | 验证的操作 | 现象 | 结论 |
| 猜想Ⅰ:固体A中含有BaCO3 | 取少量固体A于试管中,先滴入过量稀硝酸(或稀盐酸),再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | 猜想Ⅱ不成立 |
| 猜想Ⅱ:最后制得的NaCl晶体中还有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水, 先滴入BaCl2溶液,再滴入过量稀HNO3 | 有白色沉淀 | 猜想Ⅱ成立 |
9.下列物质中互为同分异构体的是( )
| A. | 13C 与 14C | B. | CH3CH2OH与CH3COOH | ||
| C. | 甲烷与丙烷 | D. | CH3CH2CH2CH3 与 CH3CH(CH3)2 |
7.有关碳元素及其化合物的化学用语正确的是( )
| A. | 碳--12 原子:612C | B. | C原子最外层电子的轨道表示式: | ||
| C. | 醋酸钠的分子式:C2H3O2Na | D. | 2-甲基-1-丙醇的结构简式: |
8.依据图中氮元素及其化合物的转化关系,判断下列说法不正确的是( )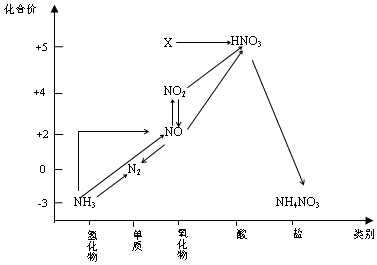

| A. | X是N2O5 | |
| B. | 可用排空气法收集NO气体 | |
| C. | 工业上以NH3、空气、水为原料生产硝酸 | |
| D. | 由NH3→N2,从原理上看,NH3可与NO2反应实现 |

 欲设计一个实验验证红热的炭与浓硫酸发生反应所生成的各种产物.某同学设计的实验流程依次为:气体产物、无水硫酸铜、品红溶液1、酸性高锰酸钾、品红溶液2、澄清石灰水.
欲设计一个实验验证红热的炭与浓硫酸发生反应所生成的各种产物.某同学设计的实验流程依次为:气体产物、无水硫酸铜、品红溶液1、酸性高锰酸钾、品红溶液2、澄清石灰水.