题目内容
设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A、4℃时9mL水和标准状况下11.2L氮气含有相同的原子数 |
| B、27g金属铝与足量的盐酸反应时,失去的电子数为2NA |
| C、常温常压下,48gO3含有的氧原子数为3NA |
| D、5.6gC2H4和C4H8混合气中含氢原子数为0.6 NA |
考点:阿伏加德罗常数
专题:
分析:A.水是3原子分子,氮气分子是双原子分子;
B.铝为3价金属,根据电子守恒计算出铝反应失去的电子数;
C.质量换算为物质的量,结合分子式计算原子数;
D.乙烯和丁烯的最简式为CH2,根据5.6g混合物中含有0.4mol最简式CH2计算出含有的碳原子数目.
B.铝为3价金属,根据电子守恒计算出铝反应失去的电子数;
C.质量换算为物质的量,结合分子式计算原子数;
D.乙烯和丁烯的最简式为CH2,根据5.6g混合物中含有0.4mol最简式CH2计算出含有的碳原子数目.
解答:
解:A.4℃时9mL水的质量为9mL×1g/mL=9g,水的物质的量为0.5mol,含有原子的物质的量为0.5mol×3=1.5mol.标况下11.2L氮气的物质的量为0.5mol,氮气分子是双原子分子,含有的原子的物质的量为0.5mol×2=1mol,故二者含有原子数目不相等,故A错误;
B.27g金属铝的物质的量为1mol,与足量的盐酸反应,铝失去3mol电子,失去的电子数为3NA,故B错误;
C.常温常压下,48gO3物质的量为1mol,含有的氧原子数为3NA,故C正确;
D.常温下,5.6gC2H4和C4H8的混合物中含有0.4mol最简式CH2,含氢原子0.8mol,含氢原子数为0.8 NA,故D错误.
故选C.
B.27g金属铝的物质的量为1mol,与足量的盐酸反应,铝失去3mol电子,失去的电子数为3NA,故B错误;
C.常温常压下,48gO3物质的量为1mol,含有的氧原子数为3NA,故C正确;
D.常温下,5.6gC2H4和C4H8的混合物中含有0.4mol最简式CH2,含氢原子0.8mol,含氢原子数为0.8 NA,故D错误.
故选C.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,试题既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
下列有关分子的结构和性质的说法中正确的是( )
| A、PCl3和SO2都是极性分子 |
| B、H2O是一种非常稳定的化合物,这是由于氢键所致 |
| C、BF3、NCl3分子中所有原子的最外层电子都满足8电子稳定结构 |
| D、凡是中心原子采取sp3杂化轨道形成的分子其几何构型都是正四面体 |
NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、5.0g C3H4中含有共用电子对的数目为NA |
| B、3.0 g淀粉和葡萄糖混合物中共含碳原子数为0.1NA |
| C、14 g乙烯和丙烯的混合物中含碳原子数为l.5NA |
| D、标准状况下,2.24L CHCl3含有的分子数为0.1NA |
下列方程式书写正确的是( )
| A、HCO3-在水溶液中的电离方程式:HCO3-+H2O?H3O++CO32- |
| B、H2SO3的电离方程式H2SO3?2H++SO32- |
| C、CO32-的水解方程式:CO32-+2H2O?H2CO3+2OH- |
| D、CuSO4的水解方程式:Cu2++2H2O?Cu(OH)2+2H+ |
下列各组物质中,按酸、碱、盐的顺序排列正确的是( )
| A、氢硫酸、烧碱、明矾 |
| B、硫酸、纯碱、石膏 |
| C、硝酸、乙醇、醋酸钠 |
| D、磷酸、熟石灰、苛性钠 |
A、B、C短周期元素在周期表中的位置如图所示,已知A、C可分别与B形成化合物X和Y,A与B的质子数之和等于C的质子数,现有以下说法,判断正确的是( )
| A | B |
| C |
| A、B形成的单质存在同素异形体,C的单质不存在同素异形体 |
| B、C的最高价氧化物对应的水化物能与A的常见氢化物形成三种盐 |
| C、常温下,B的氢化物中无H+ |
| D、Y的种类比X多 |
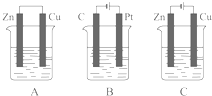 如图所示,A、B、C三个装置的烧杯中分别盛有足量的CuCl2溶液.
如图所示,A、B、C三个装置的烧杯中分别盛有足量的CuCl2溶液.