题目内容
短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素.
试回答下列问题:
(1)A的元素符号 ;D的原子结构示意图 ;C原子的外围电子排布式 ;写出B2A的电子式 ;
(2)A、B、C三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示) ;
(3)B的最高价氧化物的水化物与D元素的单质在水溶液中反应的化学方程式是 .
试回答下列问题:
(1)A的元素符号
(2)A、B、C三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)
(3)B的最高价氧化物的水化物与D元素的单质在水溶液中反应的化学方程式是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A原子的最外层电子数是次外层电子数的3倍,最外层电子数不超过8个,所以该原子的次外层是K层,则A原子最外层有6个电子,内层有2个电子,则A是O元素;A和C同主族,且为短周期元素,C的原子序数大于A,所以C是S元素;B、C、D同周期,且B、C、D原子序数依次增大,B是短周期元素中原子半径最大的主族元素,根据元素周期律知,B是Na元素,D是Cl元素,结合元素、物质的结构和性质解答.
解答:
解:A原子的最外层电子数是次外层电子数的3倍,最外层电子数不超过8个,所以该原子的次外层是K层,则A原子最外层有6个电子,内层有2个电子,则A是O元素;A和C同主族,且为短周期元素,C的原子序数大于A,所以C是S元素;B、C、D同周期,且B、C、D原子序数依次增大,B是短周期元素中原子半径最大的主族元素,根据元素周期律知,B是Na元素,D是Cl元素,
(1)通过以上分析知,A是O元素,D是Cl元素,其原子核外有17个电子,原子结构示意图为: ,C是S元素,主族元素的最外层电子就是其外围电子,则S原子的外围电子排布式为3s23p4,B是Na元素,A是O元素,Na2O中氧离子和钠离子之间存在离子键,所以氧化钠的电子式为:
,C是S元素,主族元素的最外层电子就是其外围电子,则S原子的外围电子排布式为3s23p4,B是Na元素,A是O元素,Na2O中氧离子和钠离子之间存在离子键,所以氧化钠的电子式为: ;
;
故答案为:O; ;3s23p4;
;3s23p4; ;
;
(2)A是O元素,B是Na元素,C是S元素,电子层数越多的离子,其离子半径越大,电子层结构相同的离子,其离子半径随着原子序数的增大而减小,所以A、B、C三种元素形成的简单离子的半径由大到小的顺序是S2->O2->Na+,故答案为:S2->O2->Na+;
(3)B的最高价氧化物的水化物为NaOH,D元素的单质为Cl2,二者反应的化学方程式为2NaOH+Cl2=NaCl+NaClO+H2O,故答案为:2NaOH+Cl2=NaCl+NaClO+H2O.
(1)通过以上分析知,A是O元素,D是Cl元素,其原子核外有17个电子,原子结构示意图为:
 ,C是S元素,主族元素的最外层电子就是其外围电子,则S原子的外围电子排布式为3s23p4,B是Na元素,A是O元素,Na2O中氧离子和钠离子之间存在离子键,所以氧化钠的电子式为:
,C是S元素,主族元素的最外层电子就是其外围电子,则S原子的外围电子排布式为3s23p4,B是Na元素,A是O元素,Na2O中氧离子和钠离子之间存在离子键,所以氧化钠的电子式为: ;
;故答案为:O;
 ;3s23p4;
;3s23p4; ;
;(2)A是O元素,B是Na元素,C是S元素,电子层数越多的离子,其离子半径越大,电子层结构相同的离子,其离子半径随着原子序数的增大而减小,所以A、B、C三种元素形成的简单离子的半径由大到小的顺序是S2->O2->Na+,故答案为:S2->O2->Na+;
(3)B的最高价氧化物的水化物为NaOH,D元素的单质为Cl2,二者反应的化学方程式为2NaOH+Cl2=NaCl+NaClO+H2O,故答案为:2NaOH+Cl2=NaCl+NaClO+H2O.
点评:本题考查了离子半径大小的判断、电子式的书写、轨道表示式的书写等知识点,正确推断元素是解本题关键,难点是过氧化钠电子式的书写,难度中等.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
下列变化中,△S<0的是( )
| A、氯化钠溶于水 |
| B、NH3(g)与HCl(g)反应生成NH4Cl(s) |
| C、干冰(CO2)的升华 |
| D、CaCO3(s)分解为CaO(s)和CO2(g) |
设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A、4℃时9mL水和标准状况下11.2L氮气含有相同的原子数 |
| B、27g金属铝与足量的盐酸反应时,失去的电子数为2NA |
| C、常温常压下,48gO3含有的氧原子数为3NA |
| D、5.6gC2H4和C4H8混合气中含氢原子数为0.6 NA |
已知X、Y、Z、W、T是短周期中原子序数依次增大的5种主族元素.其中Y和X两种元素可以组成1:1、1:2、1:3、1:4等多种化合物; Z原子最外层电子数是次外层电子数的3倍,W与X同主族,W与T形成的化合物WT是厨房必需的调味品.下列说法正确的是( )
| A、原子半径:T>W>Z>Y |
| B、W与T的单质可通过电解饱和的WT水溶液获得 |
| C、Z与W形成的两种化合物中化学键类型完全相同 |
| D、元素X、Z与T可形成多种酸 |
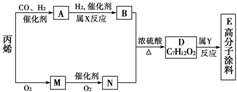 有一种广泛用于汽车、家电产品上的高分子涂料,是按下列流程生产的.图中M(C3H4O)和A均能发生银镜反应.N和M的分子中碳原子数相同,A的烃基上的一氯取代位置有三种.
有一种广泛用于汽车、家电产品上的高分子涂料,是按下列流程生产的.图中M(C3H4O)和A均能发生银镜反应.N和M的分子中碳原子数相同,A的烃基上的一氯取代位置有三种.