题目内容
NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、5.0g C3H4中含有共用电子对的数目为NA |
| B、3.0 g淀粉和葡萄糖混合物中共含碳原子数为0.1NA |
| C、14 g乙烯和丙烯的混合物中含碳原子数为l.5NA |
| D、标准状况下,2.24L CHCl3含有的分子数为0.1NA |
考点:阿伏加德罗常数
专题:
分析:A.C3H4的可能为丙炔或环丙烯,无论是那种物质,其分子中都含有4个碳碳共用电子对和4个碳氢共用电子对,总共含有4个共用电子对,据此计算出5.0gC3H4中含有共用电子对的数;
B.淀粉和葡萄糖的最简式不同,无法计算混合物中含有的碳原子数;
C.乙烯和丙烯的最简式为CH2,根据二者的最简式计算出混合物中含有的碳原子数目;
D.标准状况下,三氯甲烷不是气体,不能使用气体摩尔体积计算其物质的量.
B.淀粉和葡萄糖的最简式不同,无法计算混合物中含有的碳原子数;
C.乙烯和丙烯的最简式为CH2,根据二者的最简式计算出混合物中含有的碳原子数目;
D.标准状况下,三氯甲烷不是气体,不能使用气体摩尔体积计算其物质的量.
解答:
解:A.5.0g C3H4的物质的量为:
=
mol,C3H4分子中含有8个共用电子对,则
mol C3H4中含有共用电子对的物质的量为:
mol×8=1mol,含有共用电子对的数目为NA,故A正确;
B.淀粉和葡萄糖的最简式不相同,无法计算3.0g混合物中含有的碳原子数目,故B错误;
C.14g乙烯和丙烯的混合物中含有1mol最简式CH2,含有1mol碳原子,所含碳原子数为NA,故C错误;
D.标况下三氯甲烷不是气体,不能使用标况下的气体摩尔体积计算2.24L三氯甲烷的物质的量,故D错误;
故选A.
| 5.0g |
| 40g/mol |
| 1 |
| 8 |
| 1 |
| 8 |
| 1 |
| 8 |
B.淀粉和葡萄糖的最简式不相同,无法计算3.0g混合物中含有的碳原子数目,故B错误;
C.14g乙烯和丙烯的混合物中含有1mol最简式CH2,含有1mol碳原子,所含碳原子数为NA,故C错误;
D.标况下三氯甲烷不是气体,不能使用标况下的气体摩尔体积计算2.24L三氯甲烷的物质的量,故D错误;
故选A.
点评:本题考查阿伏加德罗常数的综合应用,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
糖尿病患者的血液和尿液中含有葡萄糖,含糖量越高,病情越严重,下列方法可以快速测出病人的尿样中是否含有葡萄糖的是( )
| A、用硫酸铜溶液测试 |
| B、用氢氧化钠溶液测试 |
| C、用新制的氢氧化铜悬浊液 |
| D、用PH试纸测试 |
反应2SO2+O2?2SO3经过一段时间后,SO3的浓度增加到了0.4mol/L,在这段时间内用O2表示的反应速率为0.04mol/(L?s),则这段时间为(( )
| A、0.1 s |
| B、2.5 s |
| C、5 s |
| D、10 s |
下列叙述中错误的是( )
| A、等物质的量的CO和CO2中所含碳原子数相等 |
| B、2mol H2O和2mol NH3含电子数相同 |
| C、等质量的O2和O3中所含氧原子个数相同 |
| D、H2SO4的摩尔质量是98g |
下列化学用语表示正确的是( )
A、甲基的电子式: |
B、氮原子的电子排布图: |
| C、氯离子的最外层电子排布:3s23p6 |
D、硫原子的结构示意图: |
设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A、4℃时9mL水和标准状况下11.2L氮气含有相同的原子数 |
| B、27g金属铝与足量的盐酸反应时,失去的电子数为2NA |
| C、常温常压下,48gO3含有的氧原子数为3NA |
| D、5.6gC2H4和C4H8混合气中含氢原子数为0.6 NA |
下列表示对应化学反应的离子方程式正确的是( )
| A、铜溶于FeCl3溶液:Cu+Fe3+=Cu2++Fe2+ |
| B、Na[Al(OH)4]溶液中通入过量CO2:[Al(OH)4]-+CO2=Al(OH)3↓+CO32- |
| C、氯化铝溶液中加过量氨水:Al3++3OH-═Al(OH)3↓ |
| D、次氯酸钠溶液中滴入浓盐酸产生氯气:ClO-+Cl-+2H+=Cl2↑+H2O |
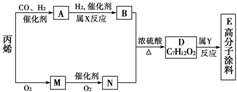 有一种广泛用于汽车、家电产品上的高分子涂料,是按下列流程生产的.图中M(C3H4O)和A均能发生银镜反应.N和M的分子中碳原子数相同,A的烃基上的一氯取代位置有三种.
有一种广泛用于汽车、家电产品上的高分子涂料,是按下列流程生产的.图中M(C3H4O)和A均能发生银镜反应.N和M的分子中碳原子数相同,A的烃基上的一氯取代位置有三种.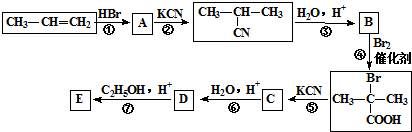
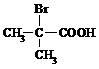 与足量NaOH溶液反应的化学方程式为
与足量NaOH溶液反应的化学方程式为