题目内容
3.化学反应H2(g)+Cl2(g)═2HCl(g)的能量变化如图所示,则下列说法中正确的是( )
| A. | 该反应是吸热反应 | |
| B. | 断裂1 mol H-H键和1 mol Cl-Cl键时能放出x kJ能量 | |
| C. | 断裂2 mol H-Cl键需要吸收y kJ的能量 | |
| D. | 2 mol HCl(g)的总能量高于1 molH2(g)和1 mol Cl2(g)的总能量 |
分析 A.根据反应物与生成物具有能量的相对大小分析;
B.断键要吸收能量;
C.断裂2mol H-Cl键需要吸收y kJ的能量;
D.根据图中反应物与生成物能量高低分析.
解答 解:A.由图可知反应物的总能量大于生成物的总能量,所以该反应为放热反应,故A错误;
B.断键要吸收能量,所以断裂1mol H-H键和1mol Cl-Cl键吸收x kJ能量,故B错误;
C.由图可知,断裂2mol H-Cl键需要吸收y kJ的能量,故C正确;
D.由图可知反应物的总能量大于生成物的总能量,即2mol HCl的总能量低于1mol H2和1mol Cl2的总能量,故D错误;
故选C.
点评 本题考查反应中的能量变化,题目难度不大,本题注意根据图象中反应物和生成物能量的相对大小分析.

练习册系列答案
相关题目
3.下列实验装置或实验操作能达到相应实验目的是( )
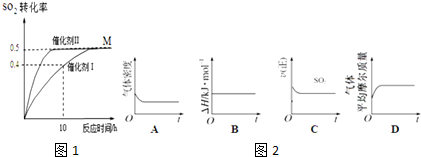
| A. |  验证酸性:H2CO3>H2SiO3 | B. | 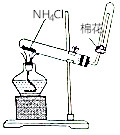 实验室制取氨气 | ||
| C. |  证明石蜡油分解生成的气体是乙烯 | D. | 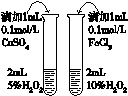 比较不同催化剂对反应速率的影响 |
11.已知H3PO3为二元酸,为中强酸,而H3AsO3的酸性与H3PO3差异很大,为极弱的酸.下列描述中不正确的是( )
| A. | H3PO3的结构为 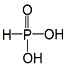 | |
| B. | H3AsO3的结构为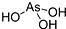 | |
| C. | H3AsO3与H3PO3一样,也为二元酸 | |
| D. | H3AsO3为三元酸,且价层电子对构型为正四面体 |
8.下列互为同分异构体的是( )
| A. | CO(NH2)2、NH4CNO | B. | 白磷、红磷 | C. | ${\;}_{1}^{2}$H、${\;}_{1}^{3}$H | D. | CH3CH2CH2CH3、 |
12.已知蓄电池在充电时作电解池,放电时作原电池.铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“-”.关于标有“+”的接线柱,下列说法中正确的是( )
| A. | 充电时作阳极,放电时作负极 | B. | 充电时作阳极,放电时作正极 | ||
| C. | 充电时作阴极,放电时作负极 | D. | 充电时作阴极,放电时作正极 |
13.同一周期X、Y、Z三种元素,已知最高价氧化物对应的水化物分别是HXO4、H2YO4、H3ZO4,则下列判断中正确的是( )
| A. | 原子半径X>Y>Z | B. | 非金属性X>Y>Z | ||
| C. | 气态氢化物的稳定性HX<H2Y<H3Z | D. | 原子序数 X<Y<Z |

 .
.