题目内容
11.已知H3PO3为二元酸,为中强酸,而H3AsO3的酸性与H3PO3差异很大,为极弱的酸.下列描述中不正确的是( )| A. | H3PO3的结构为 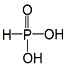 | |
| B. | H3AsO3的结构为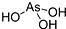 | |
| C. | H3AsO3与H3PO3一样,也为二元酸 | |
| D. | H3AsO3为三元酸,且价层电子对构型为正四面体 |
分析 A.H3PO3为二元酸,含有两个羟基为中强酸;
B.含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强,据此确定酸的结构式,H3AsO3为三元酸,含有三个羟基;
C.依据B分析可知,H3AsO3为三元酸;
D.H3AsO3的结构为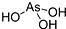 ,是四面体结构不是正四面体结构;
,是四面体结构不是正四面体结构;
解答 解:A.H3PO3为二元酸,含有两个羟基为中强酸,H3PO3的结构为  ,故A正确;
,故A正确;
B.含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强,据此确定酸的结构式,H3AsO3为三元酸,含有三个羟基,H3AsO3的结构为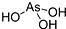 ,故B正确;
,故B正确;
C.依据B分析可知,H3AsO3的结构为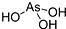 H3AsO3为三元酸,故C错误;
H3AsO3为三元酸,故C错误;
D.H3AsO3的结构为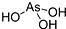 ,是四面体结构不是正四面体结构,故D错误;
,是四面体结构不是正四面体结构,故D错误;
故选CD.
点评 本题考查了酸的结构特征、酸性强弱的分析判断、主要是分子结构的理解应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.由A、B、C、D四种金属按表中装置进行实验.
根据实验现象回答下列问题:
①装置乙中正极的电极反应式是Cu2++2e-═Cu.
②四种金属活动性由强到弱的顺序是D>A>B>C.
| 装置 | 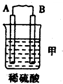 | 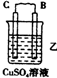 |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
①装置乙中正极的电极反应式是Cu2++2e-═Cu.
②四种金属活动性由强到弱的顺序是D>A>B>C.
8.往NaOH溶液中加入少量的稀醋酸,若温度不变,下列数据一定不变的是( )
| A. | 溶液的质量 | B. | 水的离子积 | C. | OH-物质的量浓度 | D. | 溶液pH值 |
6.下列各组中两种微粒所含电子数不相等的是( )
| A. | H3O+和OH- | B. | CO和N2 | C. | HNO3和NO3- | D. | CH3+和NH4+ |
16.下列排列顺序正确的是( )
①原子半径:Na>Al>N ②热稳定性:H2O>HF>H2S
③还原性:S2->Cl->F- ④酸性:H3PO4>H2SO4>HClO4.
①原子半径:Na>Al>N ②热稳定性:H2O>HF>H2S
③还原性:S2->Cl->F- ④酸性:H3PO4>H2SO4>HClO4.
| A. | ②④ | B. | ①③ | C. | ①④ | D. | ②③ |
3.化学反应H2(g)+Cl2(g)═2HCl(g)的能量变化如图所示,则下列说法中正确的是( )


| A. | 该反应是吸热反应 | |
| B. | 断裂1 mol H-H键和1 mol Cl-Cl键时能放出x kJ能量 | |
| C. | 断裂2 mol H-Cl键需要吸收y kJ的能量 | |
| D. | 2 mol HCl(g)的总能量高于1 molH2(g)和1 mol Cl2(g)的总能量 |
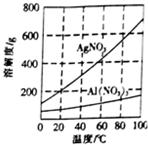 实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下:
实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下: