题目内容
13.同一周期X、Y、Z三种元素,已知最高价氧化物对应的水化物分别是HXO4、H2YO4、H3ZO4,则下列判断中正确的是( )| A. | 原子半径X>Y>Z | B. | 非金属性X>Y>Z | ||
| C. | 气态氢化物的稳定性HX<H2Y<H3Z | D. | 原子序数 X<Y<Z |
分析 同一周期X、Y、Z三种元素,已知最高价氧化物对应的水化物分别是HXO4、H2YO4、H3ZO4,则位于同周期的Z、Y、X的非金属性、原子序数均增大,原子半径减小,以此来解答.
解答 解:同一周期X、Y、Z三种元素,已知最高价氧化物对应的水化物分别是HXO4、H2YO4、H3ZO4,X位于第ⅤⅡA族,Y位于ⅥA族,Z位于ⅤA族,
A.同周期从左向右原子半径减小,则原子半径为Z>Y>X,故A错误;
B.非金属性为X>Y>Z,故B正确;
C.非金属性为X>Y>Z,则气态氢化物的稳定性HX>H2Y>H3Z,故C错误;
D.原子序数为 X>Y>Z,故D错误;
故选B.
点评 本题考查原子结构及元素周期律,为高频考点,把握最高价含氧酸判断元素的位置为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不大.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案
相关题目
3.化学反应H2(g)+Cl2(g)═2HCl(g)的能量变化如图所示,则下列说法中正确的是( )


| A. | 该反应是吸热反应 | |
| B. | 断裂1 mol H-H键和1 mol Cl-Cl键时能放出x kJ能量 | |
| C. | 断裂2 mol H-Cl键需要吸收y kJ的能量 | |
| D. | 2 mol HCl(g)的总能量高于1 molH2(g)和1 mol Cl2(g)的总能量 |
8.日本核电站泄漏物中含有放射性的53131I.有关53131I的说法不正确是( )
| A. | 中子数为78 | B. | 质子数为53 | C. | 质量数为131 | D. | 核外电子数是78 |
18.下列表述正确的是( )
| A. | 次氯酸的电子式: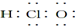 | B. | 14C的原子结构示意图: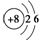 | ||
| C. | 188O2- 离子结构示意图: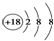 | D. | CO2的结构示为:O═C═O |
5.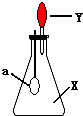 如图中,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压滴管胶头,使液体Y滴入瓶中,振荡,过一会可见小气球a鼓起.气体X和液体Y不可能是( )
如图中,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压滴管胶头,使液体Y滴入瓶中,振荡,过一会可见小气球a鼓起.气体X和液体Y不可能是( )
 如图中,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压滴管胶头,使液体Y滴入瓶中,振荡,过一会可见小气球a鼓起.气体X和液体Y不可能是( )
如图中,锥形瓶内盛有气体X,滴管内盛有液体Y.若挤压滴管胶头,使液体Y滴入瓶中,振荡,过一会可见小气球a鼓起.气体X和液体Y不可能是( )| A. | X是NH3,Y是水 | B. | X是SO2,Y是KOH浓溶液 | ||
| C. | X是CO2,Y是稀盐酸 | D. | X是HCl,Y是NaCl稀溶液 |
2.下列表示不正确的是( )
| A. | 1mol H2 | B. | 1molFe | C. | 1mol小米 | D. | 1mol NH3 |
3.在一定温度下,向1L密闭容器中加入1mol HI(g),发生反应2HI(g)?H2(g)+I2(g),2s 时生成0.1mol H2,则表示该时段的化学反应速率正确的是( )
| A. | v(HI)=0.8 mol•Lˉ1•sˉ1 | B. | v(I2)=0.2 mol•Lˉ1•sˉ1 | ||
| C. | v(HI)=0.1 mol•Lˉ1•minˉ1 | D. | v(H2)=0.05 mol•Lˉ1•sˉ1 |
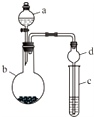 某课外小组同学设计了如图所示装置(夹持、加热仪器省略)进行系列实验.请根据下列实验回答问题:
某课外小组同学设计了如图所示装置(夹持、加热仪器省略)进行系列实验.请根据下列实验回答问题: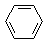 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$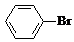 +HBr.能证明该反应是取代反应,而不是加成反应的操作和现象取反应后上层清液加硝酸银溶液,产生浅黄色沉淀.
+HBr.能证明该反应是取代反应,而不是加成反应的操作和现象取反应后上层清液加硝酸银溶液,产生浅黄色沉淀.