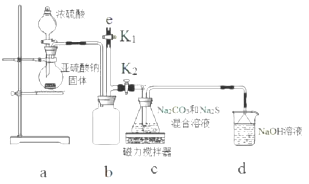
题目内容
2.化学上常用燃烧法确定有机物组成,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成,图中所列装置是用燃烧法确定有机物分子式常用的装置.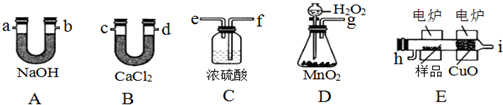
回答下列问题:
(1)产生的氧气按从左到右流向,所选择的装置各导管的连接顺序是g→f,e→h,i→c,d→a,b.
(2)C装置中浓硫酸的作用是吸收水分,得到干燥纯净的O2.
(3)若准确称取7.2g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加22g,B管质量增加10.8g,则该有机物的实验式为C5H12.
(4)要确定该有机物的分子式,则不(“是”或“不”)需要测定其他数据;若能确定其分子式,其一氯代物只有一种,则其结构简式为
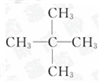 .
.
分析 据实验目的和各装置的作用推知整套装置为D→C→E→B→A,各导管接口顺序为g→f,e→h,i→c,d→a.其中D为O2发生装置(MnO2作催化剂),C中浓H2SO4作用是吸收水分,得到干燥纯净的O2,E为有机物燃烧装置,B中CaCl2吸收反应生成的H2O,A中NaOH吸收反应生成的CO2.m(CO2)=22 g,n(CO2)=0.5 mol,m(H2O)=10.8 g,则n(H2O)=0.6 mol,则m(C)+m(H)=12×0.5+0.6×2×1=7.2 g,所以该有机物的最简式为C:H=0.5:(0.6×2)=5:12,即C5H12,以此解答该题,
(1)产生氧气中含有水,应经过干燥后才可与有机物反应,生成二氧化碳和水,用无水氯化钙吸收水,用碱石灰吸水二氧化碳;
(2)C中浓H2SO4作用是吸收水分;
(3)m(CO2)=22 g,n(CO2)=0.5 mol,m(H2O)=10.8 g,则n(H2O)=0.6 mol,则m(C)+m(H)=12×0.5+0.6×2×1=7.2 g,所以该有机物的最简式为C:H=0.5:(0.6×2)=5:12,即C5H12;
(4)因最简式中氢原子数已达饱和,故C5H12就是其分子式,若其一氯代物只有一种,为新戊烷.
解答 解:据实验目的和各装置的作用推知整套装置为D→C→E→B→A,各导管接口顺序为g→f,e→h,i→c,d→a.其中D为O2发生装置(MnO2作催化剂),C中浓H2SO4作用是吸收水分,得到干燥纯净的O2,E为有机物燃烧装置,B中CaCl2吸收反应生成的H2O,A中NaOH吸收反应生成的CO2,m(CO2)=22 g,n(CO2)=0.5 mol,m(H2O)=10.8 g,则n(H2O)=0.6 mol,则m(C)+m(H)=12×0.5+0.6×2×1=7.2 g,所以该有机物的最简式为C:H=0.5:(0.6×2)=5:12,即C5H12,
(1)产生氧气中含有水,应经过干燥后才可与有机物反应,生成二氧化碳和水,用无水氯化钙吸收水,用碱石灰吸水二氧化碳,整套装置为D→C→E→B→A,各导管接口顺序为g→f,e→h,i→c,d→a,b,
故答案为:g→f,e→h,i→c,d→a,b;
(2)C中浓H2SO4作用是吸收水分,得到干燥纯净的O2,故答案为:吸收水分,得到干燥纯净的O2;
(3)m(CO2)=22 g,n(CO2)=0.5 mol,m(H2O)=10.8 g,则n(H2O)=0.6 mol,则m(C)+m(H)=12×0.5+0.6×2×1=7.2 g,所以该有机物的最简式为C:H=0.5:(0.6×2)=5:12,即C5H12,由以上分析可知该有机物的最简式为C5H12,故答案为:C5H12;
(4)因最简式中氢原子数已达饱和,故C5H12就是其分子式,若其一氯代物只有一种,则其结构简式为 ,
,
故答案为:不; .
.
点评 本题考查有机物组成的实验测定,题目难度中等,本题注意把握实验原理和方法,特别是实验的目的和基本操作,为该题的主要测试点,学习中注意把握.

| A. | 标准状况下,22.4L H20中含有的分子数为NA | |
| B. | 含2.3g Na+的Na2O和Na2O2的混合物中,阴离子总数等于0.05NA | |
| C. | 7.lgCl2 与足量的氢氧化钠溶液反应转移的电子数一定为0.2 NA | |
| D. | 1L lmol/L CaCl2溶液中含有的氯离子数为NA |
| 装置 |  |  |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
①装置乙中正极的电极反应式是Cu2++2e-═Cu.
②四种金属活动性由强到弱的顺序是D>A>B>C.
| A. | 生成的乙酸乙酯中含有18O | |
| B. | 能生成乙酸乙酯的质量为88g | |
| C. | 生成乙酸乙酯的质量为90g | |
| D. | 反应后的混合物中有两种物质含18O |
| A. | 产物乙的系统命名为2-甲基丁烷 | |
| B. | 烃甲可能是2-甲基-1,3-丁二烯 | |
| C. | 0.1 mol产物乙完全燃烧可消耗17.92L O2 | |
| D. | 烃甲与乙炔可能是同系物 |
| A. | 2 L氟化氢气体分解成1L氢气与1L氟气吸收270kJ热量 | |
| B. | 1mol氢气与1mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | |
| C. | 在相同条件下,1mol氢气与1 mol氟气的总能量大于2mol氟化氢气体的能量 | |
| D. | 1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270kJ热量 |

| A. | 该反应是吸热反应 | |
| B. | 断裂1 mol H-H键和1 mol Cl-Cl键时能放出x kJ能量 | |
| C. | 断裂2 mol H-Cl键需要吸收y kJ的能量 | |
| D. | 2 mol HCl(g)的总能量高于1 molH2(g)和1 mol Cl2(g)的总能量 |