题目内容
18.恒温恒压下,向5L的2个密闭容器中充入2molSO2和1molO2,发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0,分别选择催化剂Ⅰ、催化剂Ⅱ开始反应,达到平衡状态M,SO2转化率随时间变化如图1所示.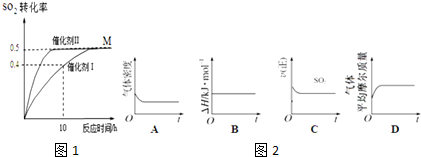
(1)下列示意图2正确且能说明反应达到平衡状态的是CD
(2)使用催化剂Ⅰ时,反应在10h内的平均反应速率:v(O2)=0.008mol•(L•h)-1达到平衡M时,比较两个容器中的正反应速率:催化剂Ⅰ< 催化剂Ⅱ(填“>”或“<”或“=”).
(3)达到平衡M时,SO2的体积分数是40%,平衡常数K=10.若升高温度,K值会减小(填增大、减小、不变)
(4)上述可逆反应达到平衡M后,将容器的体积固定,进行如下操作.
①若向容器中通入0.5molSO2和0.5molSO3,平衡将向逆向移动(填“正向”或“逆向”或“不移动”),达到平衡时得到O2的浓度为amol/L.
②若向容器中通入0.4molSO2和0.6molSO3,达到平衡时得到O2的浓度为bmol/L,则a< b(填“>”或“<”或“=”或“无法确定”).
分析 (1)达平衡时正逆反应速率相等,相关变量不随时间的改变而变化;
(2)根据反应在10小时内二氧化硫的转化率计算出消耗二氧化硫的物质的量浓度,再计算出用二氧化硫表示的平均反应速率,最后根据反应速率与化学计量数的关系计算出用氧气表示的反应速率,催化剂加快反应速率,达到平衡所需时间短;
(3)分析图象数据结合化学平衡三段式列式计算,体积分数=物质的量的分数=$\frac{二氧化硫的物质的量}{平衡混合气体总物质的量}$×100%,平衡常数等于平衡状态生成物平衡浓度除以反应物平衡浓度;正反应是放热反应,若升高温度,K值会减小;
(4)①若向容器中通入0.5molSO2和0.5molSO3,相当于投1molSO2和0.25molO2,相当于减少反应物的量平衡逆向移动;
②若向容器中通入0.4molSO2和0.6molSO3,相当于投1molSO2和0.3molO2,根据平衡移动的原理,可以当作在①平衡的基础上加0.05mol的氧气,所以平衡移动的结果是向减弱这种改变的方向移动,但未抵消.
解答 解:(1)A、气体的密度始终不变,故错误;
B、反应热始终不变,故错误;
C、用二氧化硫表示正反应速率不变,说明二氧化硫的物质的量浓度不变,反应达平衡状态,故正确;
D、气体的平均相对分子量不变,说明气体的物质的量不变,反应达平衡状态,故正确;
故选:CD;
(2)用催化剂I时,反应在10小时内二氧化硫的转化率为0.4,二氧化硫的浓度变化为:$\frac{2}{5}$mol•L-1×0.4=0.16mol/L,则反应在10小时内二氧化硫的平均反应速率为:v(SO2)=$\frac{0.16mol/L}{10h}$=0.016mol•(L•h)-1,则v(O2)=$\frac{1}{2}$v(SO2)=0.008mol•(L•h)-1,达到平衡M时催化剂I需要的时间长,则两个容器中的正反应速率催化剂I<催化剂Ⅱ,
故答案为:0.008;<;
(3)反应为2SO2(g)+O2(g)?2SO3(g),结合化学平衡三段式列式,平衡时二氧化硫转化率为50%,反应的二氧化硫物质的量=50%×2=1mol,
2SO2(g)+O2(g)?2SO3(g),
起始量(mol) 2 1 0
变化量(mol) 1 0.5 1
平衡量(mol) 1 0.5 1
二氧化硫的体积分数=$\frac{1}{2.5}$×100%=40%
平衡常数=$\frac{(\frac{1}{5})^{2}}{(\frac{1}{5})^{2}×\frac{0.5}{5}}$=10,正反应是放热反应,若升高温度,K值会减小;故答案为:40%、10、减小;
(4)①若向容器中通入0.5molSO2和0.5molSO3,相当于投1molSO2和0.25molO2,相当于减少反应物的量平衡逆向移动,故答案为:逆向;
②若向容器中通入0.4molSO2和0.6molSO3,相当于投1molSO2和0.3molO2,根据平衡移动的原理,可以当作在①平衡的基础上加0.05mol的氧气,所以平衡移动的结果是向减弱这种改变的方向移动,但未抵消,所以平衡时②中的氧气的量>①中氧气的量,故答案为:<.
点评 本题考查了平衡状态的判断和化学平衡的计算应用,平衡常数的计算应用是解题关键,题目难度中等.

 备战中考寒假系列答案
备战中考寒假系列答案| A. | 生成的乙酸乙酯中含有18O | |
| B. | 能生成乙酸乙酯的质量为88g | |
| C. | 生成乙酸乙酯的质量为90g | |
| D. | 反应后的混合物中有两种物质含18O |
| A. | 当生成的沉淀量达到最大时,消耗NaOH溶液的体积V≥100 mL | |
| B. | 当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4mol | |
| C. | 参加反应的金属的总质量为9.6 g>m>3.6 g | |
| D. | 当金属全部溶解时收集到NO气体的体积一定为2.24 L |
| A. | H3O+和OH- | B. | CO和N2 | C. | HNO3和NO3- | D. | CH3+和NH4+ |
| A. | 非金属性:F>Cl>S | B. | 熔点:I2>H2O>H2S | ||
| C. | 稳定性:HF>H2S>H2O | D. | 碱性:KOH>NaOH>Al(OH)3 |

| A. | 该反应是吸热反应 | |
| B. | 断裂1 mol H-H键和1 mol Cl-Cl键时能放出x kJ能量 | |
| C. | 断裂2 mol H-Cl键需要吸收y kJ的能量 | |
| D. | 2 mol HCl(g)的总能量高于1 molH2(g)和1 mol Cl2(g)的总能量 |
| A. | 乙烯的结构简式可以表示为CH2CH2 | |
| B. | 甲烷和苯都能发生取代反应 | |
| C. | 乙醇、乙烷和乙酸都可以与钠反应生成氢气 | |
| D. | 石油的分馏和煤的干馏都是物理变化 |
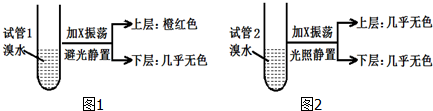
| A. | 相同条件下,X的密度比水小 | |
| B. | X的同分异构体共有5种 | |
| C. | X与溴水因发生加成反应而使溴水褪色 | |
| D. | 实验后试管2中的有机层在上层还是下层,可通过加水确定 |
| A. | 中子数为78 | B. | 质子数为53 | C. | 质量数为131 | D. | 核外电子数是78 |