题目内容
2.下列化学用语正确的是( )| A. | 甲烷分子的球棍模型  | B. | 醛基的电子式  | ||
| C. | 乙酸的结构简式 C2H4O2 | D. | 乙烯的最简式为 CH2 |
分析 A. 为甲烷的比例模型,不是球棍模型;
为甲烷的比例模型,不是球棍模型;
B.醛基中O原子最外层达到8电子稳定结构,该电子式漏掉了O的2对未成键电子对;
C.C2H4O2为分子式,结构简式中需要标出官能团结构;
D.乙烯的分子式为C2H4,据此判断其最简式.
解答 解:A.甲烷为正四面体结构,分子中含有4个碳氢键,甲烷正确的球棍模型为: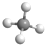 ,故A错误;
,故A错误;
B.醛基中碳原子含有一个孤电子,碳原子和氧原子形成两对共用电子对、和氢原子形成一对共用电子对,C、O误差都满足8电子稳定结构,其正确的电子式为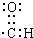 ,故B错误;
,故B错误;
C.乙酸分子中含有羧基,其正确的结构简式为:CH3COOH,故C错误;
D.最简式为分子中各原子的最简比,乙烯的分子式为C2H4,其最简式为CH2,故D正确;
故选D.
点评 本题考查常见化学用语的表示方法,题目难度中等,涉及电子式、球棍模型、结构简式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
17. 短周期元素A、B、C的位置如图所示,已知B、C两元素所在族序数之和是A元素所在族序数的二倍,B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是( )
短周期元素A、B、C的位置如图所示,已知B、C两元素所在族序数之和是A元素所在族序数的二倍,B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是( )
 短周期元素A、B、C的位置如图所示,已知B、C两元素所在族序数之和是A元素所在族序数的二倍,B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是( )
短周期元素A、B、C的位置如图所示,已知B、C两元素所在族序数之和是A元素所在族序数的二倍,B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是( )| A. | Be、Na、Al | B. | C、Al、P | C. | O、P、Cl | D. | B、Mg、S |
7.化学与生活密切相关.下列有关说法错误的是( )
| A. | SO2和NO2是主要的大气污染物 | |
| B. | 大气中的SO2和CO2溶于水形成酸雨 | |
| C. | 以液化石油气代替燃油可减少大气污染 | |
| D. | 对煤燃烧后形成的烟气脱硫,目前主要用石灰法 |
14.属于铝热反应的是( )
| A. | Al+HCl | B. | Al+H2SO4 | C. | Al+Mg | D. | Al+WO3 |
11. 当前情况下散烧煤和没有清洁的煤是造成中国城市雾霾或者东部雾霾的主要原因,煤的气化是解决雾霾,清洁地利用煤炭的重要途径之一.
当前情况下散烧煤和没有清洁的煤是造成中国城市雾霾或者东部雾霾的主要原因,煤的气化是解决雾霾,清洁地利用煤炭的重要途径之一.
(1)已知:H2O(g)=H2O(l)△H=44KJ/mol
①请写出煤的气化反应生成合成气(CO和H2)的热化学方程式H2O(g)+C(s)=CO(g)+H2(g)△H=+131.3kJ/mol.
②在恒温、恒容的反应器中,能表明上述反应达到平衡状态的是abef.
a.混合气体平均相对分子质量不再改变 b.气体压强不再改变
c.各气体浓度相等 d.反应体系中温度保持不变
e.断裂氢氧键速率是断裂氢氢键速率的2倍 f.混合提前密度不变
g.单位时间内,消耗水的质量与生成氢气的质量比为9:1
(2)甲醇是重要的化工原料,又可作为燃料,工业上利用合成气(主要成分为CO、CO2、H2)在催化剂的作用下合成甲醇,其中部分主要反应如下:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-58kJ/mol
①请推断该反应自发进行的条件为由于该反应△S<0,△H<0,故根据△G=△H-T△S<0,反应自发,可判断该反应在低温下能自发进行.
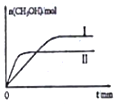
②若将1 mol CO2和2 mol H2充入容积为2L的恒容密闭容器中,在两种不同温度下发生反应,测得CH3OH的物质的量随时间的变化如图所示.曲线Ⅰ、Ⅱ对应的平成常数大小关系为KⅠ>KⅡ(填“>”或“=”或“<”);若5 min后反应达到平衡状态,H2的转化率为90%,则用CO2表示的平均反应速率为0.06mol/(L.min),该温度下的平衡常数为450;若容器容积不变,下列措施可增加甲醇产率的是d.
a.升高温度 b.使用合适的催化剂 c.充入He d.按原比例再充入CO2和H2
③CH4燃料电池利用率很高,装置中添加1L 2mol/L的KOH溶液为电解质,持续缓慢通入标准状况下甲烷2.24L时负极电极反应为CH4-8e-+10OH-=CO32-+7H2O.
 当前情况下散烧煤和没有清洁的煤是造成中国城市雾霾或者东部雾霾的主要原因,煤的气化是解决雾霾,清洁地利用煤炭的重要途径之一.
当前情况下散烧煤和没有清洁的煤是造成中国城市雾霾或者东部雾霾的主要原因,煤的气化是解决雾霾,清洁地利用煤炭的重要途径之一.(1)已知:H2O(g)=H2O(l)△H=44KJ/mol
| 物质 | H2(g) | C(s) | CO(g) |
| 燃烧热KJ/mol | 285.8 | 393.5 | 283.0 |
②在恒温、恒容的反应器中,能表明上述反应达到平衡状态的是abef.
a.混合气体平均相对分子质量不再改变 b.气体压强不再改变
c.各气体浓度相等 d.反应体系中温度保持不变
e.断裂氢氧键速率是断裂氢氢键速率的2倍 f.混合提前密度不变
g.单位时间内,消耗水的质量与生成氢气的质量比为9:1
(2)甲醇是重要的化工原料,又可作为燃料,工业上利用合成气(主要成分为CO、CO2、H2)在催化剂的作用下合成甲醇,其中部分主要反应如下:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-58kJ/mol
①请推断该反应自发进行的条件为由于该反应△S<0,△H<0,故根据△G=△H-T△S<0,反应自发,可判断该反应在低温下能自发进行.
②若将1 mol CO2和2 mol H2充入容积为2L的恒容密闭容器中,在两种不同温度下发生反应,测得CH3OH的物质的量随时间的变化如图所示.曲线Ⅰ、Ⅱ对应的平成常数大小关系为KⅠ>KⅡ(填“>”或“=”或“<”);若5 min后反应达到平衡状态,H2的转化率为90%,则用CO2表示的平均反应速率为0.06mol/(L.min),该温度下的平衡常数为450;若容器容积不变,下列措施可增加甲醇产率的是d.
a.升高温度 b.使用合适的催化剂 c.充入He d.按原比例再充入CO2和H2
③CH4燃料电池利用率很高,装置中添加1L 2mol/L的KOH溶液为电解质,持续缓慢通入标准状况下甲烷2.24L时负极电极反应为CH4-8e-+10OH-=CO32-+7H2O.
 I.20mL0.1mol/LBaCl2溶液中Cl-的物质的量浓度为0.2mol/L,Ba2+的物质的量为0.002mol.
I.20mL0.1mol/LBaCl2溶液中Cl-的物质的量浓度为0.2mol/L,Ba2+的物质的量为0.002mol. .A+、C2-、D-中离子半径最小的是Na+.(用具体离子符号表示)
.A+、C2-、D-中离子半径最小的是Na+.(用具体离子符号表示) _.
_.