题目内容
12.下列说法错误的是( )| A. | 1mol任何物质都含有约6.02×1023个原子 | |
| B. | 0.012kg碳-12含有约6.02×1023个碳原子 | |
| C. | 阿伏伽德罗常数的数值约等于6.02×1023 | |
| D. | 使用摩尔时必须指明微粒的名称 |
分析 A、物质不一定由原子构成;
B、将12g12C中含有的碳原子个数称为阿伏伽德罗常数;
C、阿伏伽德罗常数的数值约为6.02×1023;
D、在使用物质的量描述物质时,必须指明微粒的种类.
解答 解:A、物质不一定由原子构成,还可能是由分子或离子构成,故A错误;
B、将12g12C中含有的碳原子个数称为阿伏伽德罗常数,即0.012kg碳-12含有约6.02×1023个碳原子,故B正确;
C、阿伏伽德罗常数的数值约为6.02×1023,单位为mol-1,故C正确;
D、在使用物质的量描述物质时,必须指明微粒的种类,而物质的量的单位为mol,故使用摩尔时应指明微粒的名称,故D正确.
故选A.
点评 本题考查了阿伏伽德罗常数的数值和阿伏伽德罗常数的单位,掌握基础是关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.两种气态烃的混合气体共0.5mol,在空气中完全燃烧生成标准状况下CO216.8L和18g水,关于该混合气体的说法正确的是( )
①一定有CH4②一定有C2H4③一定没有C2H6④可能有C2H4⑤可能有C3H4.
①一定有CH4②一定有C2H4③一定没有C2H6④可能有C2H4⑤可能有C3H4.
| A. | ①③④ | B. | ①②④⑤ | C. | ①④⑤ | D. | ①③④⑤ |
20.在2A+B?3C+4D反应中,表示该反应速率最快的是( )
| A. | VA═0.5mol L-1S-1 | B. | VB═0.3mol L-1S-1 | ||
| C. | VC═4.8mol L-1min-1 | D. | VD═1mol L-1S-1 |
7.为了尽可能准确量取50mL某溶液,应选用的仪器是( )
| A. | 50mL烧杯 | B. | 25mL量筒 | C. | 100mL容量瓶 | D. | 500mL量杯 |
5.下列目的能达到的是( )
| A. | 将58.5 g NaCl溶于1 L水中可得1 mol•L-1的NaCl溶液 | |
| B. | 从1 L 1 mol/L的NaCl溶液中取出10 mL,其浓度仍是1 mol/L | |
| C. | 中和100 mL 1 mol/L的H2SO4溶液生成正盐,需NaOH 4 g | |
| D. | 将78 g Na2O2溶于水,配成1 L溶液可得到浓度为1 mol•L-1溶液 |
12.海水资源的利用具有广阔前景.海水中主要离子的含量如下表所示.
利用海水可以提取溴和镁,提取过程如下.
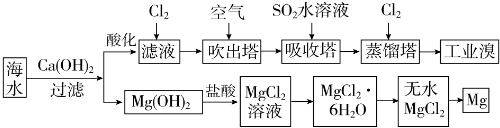
(1)提取溴的过程中,经过两次Br-→Br2转化的目的是:①对溴元素进行富集,
吸收塔中发生反应的离子方程式是:②SO2+Br2+2H2O═4H++2Br-+SO4 2-.
用平衡移动原理解释通空气的目的:③通入空气将溴蒸气带出,使Br2(g)?Br2(aq)(或Br2+H2O?HBr+HBrO)平衡向左移动.
(2)吸收塔中也可采用纯碱吸收Br2,主要反应如下,请配平并表示出电子转移的方向和数目:
□Br2+□Na2CO3+□H2O→□NaBr+□NaBrO3+□NaHCO3
(3)从MgCl2溶液中得到MgCl2•6H2O晶体的主要操作是①加热浓缩、冷却结晶、过滤、洗涤、干燥.最后一步冶炼得到金属镁的化学方程式为②MgCl2(熔融) $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;冶炼时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式③Mg+2H2O $\frac{\underline{\;高温\;}}{\;}$Mg(OH)2+H2↑.
(4)依据上述流程,若将10m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为179.2L(忽略Cl2的溶解).
| 成分 | 含量(mg•L-1) | 成分 | 含量(mg•L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO4 2- | 2560 | Br- | 64 |
| Mg2+ | 1272 |

(1)提取溴的过程中,经过两次Br-→Br2转化的目的是:①对溴元素进行富集,
吸收塔中发生反应的离子方程式是:②SO2+Br2+2H2O═4H++2Br-+SO4 2-.
用平衡移动原理解释通空气的目的:③通入空气将溴蒸气带出,使Br2(g)?Br2(aq)(或Br2+H2O?HBr+HBrO)平衡向左移动.
(2)吸收塔中也可采用纯碱吸收Br2,主要反应如下,请配平并表示出电子转移的方向和数目:
□Br2+□Na2CO3+□H2O→□NaBr+□NaBrO3+□NaHCO3
(3)从MgCl2溶液中得到MgCl2•6H2O晶体的主要操作是①加热浓缩、冷却结晶、过滤、洗涤、干燥.最后一步冶炼得到金属镁的化学方程式为②MgCl2(熔融) $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;冶炼时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式③Mg+2H2O $\frac{\underline{\;高温\;}}{\;}$Mg(OH)2+H2↑.
(4)依据上述流程,若将10m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为179.2L(忽略Cl2的溶解).
9.NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA | |
| B. | 1mol (NH4)2Fe(SO4)2•6H2O晶体中含有离子总数为5NA | |
| C. | 常温常压下,2.24 L SO2和O2的混合气体中含有的氧原子总数为0.2 NA | |
| D. | 1 L 0.1 mol•L-1的NaHCO3溶液中含的CO32-和HCO3-总数为0.1NA |
10.用VSEPR模型预测下列分子或离子的立体结构,其中正确的是( )
| A. | SO2直线形 | B. | CO2平面三角形 | C. | BCl3三角锥形 | D. | CH4正四面体形 |
