题目内容
16.pH在表示溶液的酸碱性方面有重要的应用,请按要求完成填空(1)常温下,pH=12的NaOH溶液的其浓度c(NaOH)=10-2mol/L mol/L
(2)常温下,某一元弱酸溶液的pH=1,其浓度>0.1mol/L(填“>”、“<”或“=”);
(3)常温下,将100mL 0.1mol/L醋酸溶液和50mL 0.2mol/LNaOH溶液均匀混合后,溶液显碱性(填“酸性”、“碱性”或“中性”),其原因是CH3COO-+H2O?CH3COOH+OH-;(请用相关的离子方程式作答)
(4)25℃时,若体积为Va、pH=a的某一元强酸HA与体积为Vb、pH=b的某一元强碱BOH混合恰好中和,且已知Va<Vb和a=0.5b,则 a的取值范围是3.5<a<$\frac{14}{3}$.
分析 (1)常温下,pH=12的NaOH溶液总存在离子积常数,氢氧化钠完全电离溶液中氢氧根离子浓度即为氢氧化钠浓度;
(2)常温下,某一元弱酸溶液中存在电离平衡;
(3)醋酸是一元弱酸,氢氧化钠是一元碱,等物质的量的二者恰好反应生成醋酸钠,醋酸根离子水解溶液显碱性;
(4)酸、碱都是一元强电解质,pH=a的一元强酸溶液中氢离子浓度=10-a mol/L,pH=b的一元强碱中氢氧根离子浓度=10 b-14 mol/L,二者恰好反应时,说明酸和碱的物质的量相等;
解答 解:(1)常温下,pH=12的NaOH溶液中存在离子积常数,c(H+)c(OH-)=10-14,C(OH-)=$\frac{1{0}^{-14}}{1{0}^{-12}}$=10-2mol/L,其浓度c(NaOH)=10-2mol/L,
故答案为:10-2mol/L;
(2)常温下,某一元弱酸溶液中存在电离平衡,溶液的pH=1是氢离子浓度为0.1mol/L,则其浓度大于0.1mol/L,
故答案为:>;
(3)常温下,将100mL 0.1mol/L醋酸溶液和50mL 0.2mol/LNaOH溶液均匀混合后,醋酸物质的量=0.1mol/L×0.1L=0.01mol,50mL 0.2mol/LNaOH溶液中溶质物质的量=0.050L×0.2mol/L=0.01mol,二者恰好完全反应生成醋酸钠,醋酸根离子失弱酸阴离子,水溶液中水解显碱性,CH3COO-+H2O?CH3COOH+OH-,
故答案为:碱性;CH3COO-+H2O?CH3COOH+OH-;
(4)酸、碱都是一元强电解质,pH=a的一元强酸溶液中氢离子浓度=10-a mol/L,pH=b的一元强碱中氢氧根离子浓度=10 b-14 mol/L,二者恰好反应时,酸和碱的物质的量相等,即:
10-a mol/L×VaL=10 b-14 mol/L×VbL,$\frac{{V}_{a}}{{V}_{b}}$
=$\frac{1{0}^{b-14}}{1{0}^{-a}}$=10 a+b-14,
Va<Vb,
所以10 a+b-14<1,
所以a+b<14,
又a=0.5b,
所以3a<14,
所以a<$\frac{14}{3}$;
b>7,a=0.5b>0.5×7=3.5,
所以得到:3.5<a<$\frac{14}{3}$,
故答案为:3.5<a<$\frac{14}{3}$.
点评 本题考查了盐类水解、弱电解质的电离、离子积常数的有关计算等知识点,根据弱电解质电离特点、盐类水解特点来分析解答即可,注意把握溶液PH的计算,题目难度中等.

| t/s | 0 | 500 | 1 000 | 1 500 |
| c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500 s内N2O5分解速率为2.96×10-3 mol/(L•s) | |
| B. | T1温度下的平衡常数为K1=125,1 000 s时转化率为50% | |
| C. | 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2 | |
| D. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2 |
| A. | 配制90mL1.00mol/L的NaCl溶液,用托盘天平称取5.3gNaCl固体 | |
| B. | 使用容量瓶时,先检验其是否漏水,然后洗净后,不用干燥即可使用 | |
| C. | 可用10mL量筒量取8.58mL蒸馏水 | |
| D. | 在配制溶液定容后,上下翻转摇匀后发现液面下降,须加水至溶液凹液面与刻度线相切 |
| A. | 恒容容器内混合气体的密度不再变化 | |
| B. | AB3的生成速率与B2的生成速率之比为2:3 | |
| C. | 恒压容器内混合气体的总物质的量不再变化 | |
| D. | 单位时间内断裂a mol A≡A键,同时断裂6a mol A-B键 |
| A. | Cu2+ Cl- K+ SO42- | B. | Na+ NO3 - OH - CO3 2- | ||
| C. | Ba2+ Cl- NO3 - SO4 2- | D. | K+ Na+ Cl- SO4 2- |
| A. | 向水中加入少量Na固体,平衡逆向移,c(H+)降低 | |
| B. | 向水中加入稀氨水,平衡逆向移动,c(OH-)降低 | |
| C. | 向水中加入少量硫酸氢钠固体,c(H+)增大,Kw不变动 | |
| D. | 将水加热,Kw增大,pH不变 |

下列说法正确的是( )
| A. | 滤液A中的阳离子为Fe2+、Fe3+、H+ | |
| B. | 该样品中Cu、O元素的质量比为10:l | |
| C. | V=448 | |
| D. | 溶解样品时消耗H2SO4的物质的量为0.04 mo1 |
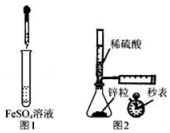
| A. | 制备Fe(OH)2:用图1所示装置,向试管中加入NaOH溶液,振荡 | |
| B. | 测定H2的生成速率:用图2所示装置,制取一定体积的H2,记录时间 | |
| C. | 中和热测定实验中把盐酸分多次加入氢氧化钠溶液中 | |
| D. | 酸碱中和滴定实验中锥形瓶需要用待测液润洗 |
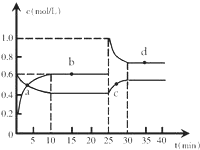 在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中发生反应:N2O4 (g)?2NO2 (g)△H>0,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中发生反应:N2O4 (g)?2NO2 (g)△H>0,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.