题目内容
7.N2O5是一种新型硝化剂,一定温度下发生2N2O5(g)?4NO2(g)+O2(g)△H>0,T1温度下的部分实验数据为| t/s | 0 | 500 | 1 000 | 1 500 |
| c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500 s内N2O5分解速率为2.96×10-3 mol/(L•s) | |
| B. | T1温度下的平衡常数为K1=125,1 000 s时转化率为50% | |
| C. | 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2 | |
| D. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2 |
分析 A.结合v=$\frac{△c}{△t}$计算;
B.2N2O5(g)?4NO2(g)+O2(g)
开始 5 0 0
转化 2.5 5 1.25
平衡 2.5 5 1.25
K为生成物浓度幂之积与反应物浓度幂之积的比,结合转化率=$\frac{转化的量}{开始的量}$×100%;
C.由实验数据可知1 000 s时N2O5(g)浓度为2.5mol/L,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,降低温度平衡逆向移动;
D.△H>0为吸热反应,温度越高K越大.
解答 解:A.500 s内N2O5分解速率为$\frac{5mol/L-3.52mol/L}{500s}$=2.96×10-3 mol/(L•s),故A正确;
B.2N2O5(g)?4NO2(g)+O2(g)
开始 5 0 0
转化 2.5 5 1.25
平衡 2.5 5 1.25
K=$\frac{1.25×{5}^{4}}{2.{5}^{2}}$=125,转化率=$\frac{转化的量}{开始的量}$×100%=$\frac{2.5}{5}$×100%=50%,故B正确;
C.由实验数据可知1 000 s时N2O5(g)浓度为2.5mol/L,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,降低温度平衡逆向移动,则T1>T2,故C错误;
D.△H>0为吸热反应,温度越高K越大,则T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2,故D正确;
故选C.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、K及转化率的计算为解答的关键,侧重分析与计算能力的考查,注意该反应为吸热反应,题目难度不大.

 导学全程练创优训练系列答案
导学全程练创优训练系列答案| A. |  | B. |  | C. |  | D. |  |
时间s 浓度mol/L | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
(1)该反应达到平衡时,四氧化二氮的转化率为60%,表中c2>c3(填“>”、“<”或“=”).
(2)20s时四氧化二氮的浓度c1=0.070mol/L,在0s~20s时间段内,四氧化二氮的平均反应速率为0.0015mol/(L•s).
(3)100℃时,该反应的平衡常数K=0.36mol/L.
(4)若在相同情况下最初向该容器中充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是0.200mol/L.
(5)若在相同情况下向该容器中充入0.2mol四氧化二氮和0.3mol二氧化氮气体,则到达平衡前v(正)> v(逆)(填“>”、“<”或“=”).
 甲醇是重要的化工原料,又可做为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料,又可做为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:ⅠCO(g)+2H2(g)?CH3OH(g)△H1
ⅡCO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2=-58kJ/mol
ⅢCO2(g)+H2(g)?CO(g)+H2O(g)△H3
回答下列问题:
(1)物质的标准生成热是常用的化学热力学数据,可以用来计算化学反应热.即化学反应热:△H=生成物标准生成热综合-反应物标准生成热总和.
已知四种物质的标准生成热如表:
| 物质 | CO | CO2 | H2 | CH3OH(g) |
| 标准生成热(kJ/mol) | -110.52 | -393.51 | 0 | -201.25 |
B.△H3>0(填=、<、>)
(2)由甲醇在一定条件下制备甲醚.一定温度下,在三个体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g)?CH3OCH3(g)+H2O(g).实验数据见表:
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |||
| CH3OH(g) | CH3OCH3(g) | H2O(g) | CH3OCH3(g) | H2O(g) | ||
| a | 387 | 0.20 | 0 | 0 | 0.080 | 0.080 |
| b | 387 | 0.40 | 0 | 0 | ||
| c | 207 | 0.20 | 0 | 0 | 0.090 | 0.090 |
A.该反应的正反应为放热反应
B.达到平衡时,容器a中的CH3OH体积分数比容器b中的小
C.容器a中反应到达平衡所需时间比容器c中的长
D.若起始时向容器a中充入CH3OH 0.15mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
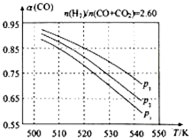
(3)合成气的组成$\frac{n({H}_{2})}{n(CO+C{O}_{2})}$=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图所示.
①α(CO)值随温度升高而减小(填“增大”或“减小”),其原因是反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中CO的增大,总结果,随温度升高,CO的转化率减小.
②图中P1、P2、P3的大小关系为P1>P2>P3,其判断理由是相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大,故增大压强有利于CO的转化率升高.
(4)甲醇可以制成燃料电池,与合成气制成燃料电池相比优点是:装置简单,减小了电池的体积;若以硫酸作为电解质其负极反应为:CH3OH-6e-+H2O=CO2+6H+.
| A. | 75mL 2mol•L-1氯化镁溶液 | B. | 150mLl 1 mol•L-1氯化钠溶液 | ||
| C. | 50mL3mol•L-1氯化钾溶液 | D. | 50mL 1 mol•L-1氯化铁溶液 |
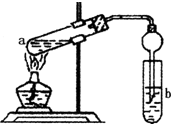 如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.
如图,在左试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装置,用酒精灯对左试管小火加热3~5min后,改用大火加热,当观察到右试管中有明显现象时停止实验.