题目内容
10.下列溶液中,跟100ml0.5moL/LNaCl溶液所含的Cl-的物质的量浓度相同的是( )| A. | 100mL0.5mol/LMgCl2溶液 | B. | 200mL0.25mol/LCaCl2溶液 | ||
| C. | 50mL1mol/LNaCl 溶液 | D. | 25mL0.5mol/LAlCl3溶液 |
分析 0.5moL/LNaCl溶液所含的Cl-的物质的量浓度为0.5mol/L,结合溶质浓度、物质的构成计算离子浓度,与溶液体积无关,以此来解答.
解答 解:A.0.5mol/LMgCl2溶液中Cl-的物质的量浓度为0.5mol/L×2=1mol/L,故A不选;
B.0.25mol/LCaCl2溶液中Cl-的物质的量浓度为0.25mol/L×2=0.5mol/L,故B选;
C.1mol/LNaCl 溶液中Cl-的物质的量浓度为1mol/L,故C不选;
D.0.5mol/LAlCl3溶液中Cl-的物质的量浓度为0.5mol/L×3=1.5mol/L,故D不选;
故选B.
点评 本题考查物质的量浓度的计算,为高考常见题型,侧重于学生的计算能力的考查,把握溶质浓度与物质的构成为解答的关键,注意离子浓度与溶液体积无关,题目难度不大.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
13.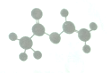 法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖:轮烷是一种分子机器的一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )
法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖:轮烷是一种分子机器的一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )
 法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖:轮烷是一种分子机器的一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )
法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖:轮烷是一种分子机器的一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )| A. | 该化合物的名称为乙酸乙酯 | |
| B. | 该化合物可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且反应类型相同 | |
| C. | 该化合物既能发生取代反应,又能发生加成反应和氧化反应 | |
| D. | 该化合物的同分异构体中,能与NaHCO3反应放出CO2的只有2种 |
1.下列反应的离子方程式正确的是( )
| A. | NaHCO3溶液与盐酸:CO32-+2 H+═H2O+CO2↑ | |
| B. | 向澄清的石灰水中加入过量的小苏打溶液:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| C. | 向硝酸亚铁溶液中加入稀硫酸:Fe2++4H++NO3-═Fe3++NO↑+2H2O | |
| D. | AlCl3溶液与过量氨水反应:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
18.已知(NH4)2SO4+2NaOH=Na2SO4+2NH3•H2O,现将400mLMgCl2、K2SO4、(NH4)2SO4的混合溶液分成两等份,取一份加入含amolBaCl2的溶液,刚好使SO42-沉淀完全,继续加入含bmolAgNO3的溶液,刚好使Cl-沉淀完全,另取一份加入含cmolNaOH的溶液,恰好完全反应,则该溶液中K+浓度为( )
| A. | 5(b+2a-c) | B. | $\frac{5(2b-c)}{3}$ | C. | $\frac{5(2b-a+c)}{3}$ | D. | 5(b-c) |
5.某无色透明的酸性溶液中,能大量共存的离子组是( )
| A. | K+、Na+、SO42-、HCO3- | B. | K+、Na+、Cl-、SO42- | ||
| C. | K+、Cu2+、NO3-、SO42- | D. | K+、Fe2+、NO3-、Cl- |
20.下列醇类既能发生催化氧化反应又能发生消去反应的是( )
| A. | 2-丙醇 | B. | 3-乙基-3-戊醇 | ||
| C. | 2,2-二甲基-1-戊醇 | D. |  |