题目内容
8. 已知:
已知:①4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H1=-905.5kJ•molˉ1
②N2(g)+O2(g)?2NO(g)△H2
一定条件下,NO可以与NH3反应转化为无害的物质,反应如下:
③4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H3=-1625.5 kJ•molˉ1下列说法正确的是( )
| A. | 反应①使用催化剂,△H1减小 | |
| B. | 反应②生成物总能量低于反应物总能量 | |
| C. | 反应③一定能自发进行 | |
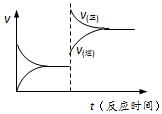
| D. | 反应③达到平衡后升高温度,v(正)、v(逆)的变化如图所示 |
分析 A.若正逆反应速率同等程度增大,则为使用了催化剂;
B.①4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H1=-905.5kJ•molˉ1
③4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H3=-1625.5 kJ•molˉ1,$\frac{①-③}{4}$得N2(g)+O2(g)?2NO(g)△H2,并据△H进行判断据;
C.化学反应能否自发进行,取决于焓变和熵变的综合判据,当△G=△H-T•△S<0时,反应能自不发进行;
D.据平衡移动分析.
解答 解:A.正反应速率增大,且大于逆反应速率,则应为增大压强或增加反应物浓度,故A错误;
B.①4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H1=-905.5kJ•molˉ1
③4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H3=-1625.5 kJ•molˉ1,$\frac{①-③}{4}$得N2(g)+O2(g)?2NO(g)△H2=180kJ•molˉ1,△H>0故此反应为吸热反应,故生成物总能量高于反应物总能量,故B错误;
C.反应③△H<0,△S>0时,△G=△H-T•△S<0,该反应一定能自发进行,故C正确;
D.升高温度,向吸热方向进行,则向逆反应方向进行,即V逆>V正,与图象不符,故D错误,
故选C.
点评 本题考查平衡移动判断,影响化学平衡的因素,用△G判定反应能否自发进行等,本题难度中等.

练习册系列答案
相关题目
16. 化学反应速率和限度与生产、生活密切相关.
化学反应速率和限度与生产、生活密切相关.
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(累计值):
①哪一时间段反应速率最大2~3min(填0~1、1~2、2~3、3~4、4~5),原因是因该反应是放热反应,此时温度高且盐酸浓度较大,所以反应速率较快.
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率0.025mol/(L•min)(设溶液体积不变).
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是CD.
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图.
①该反应的化学方程式是3X+Y?2Z.
②该反应达到平衡状态的标志是CD
A.X、Y、Z的反应速率相等
B.X、Y的反应速率比为3:1
C.容器内气体压强保持不变
D.生成1mol Y的同时生成2mol Z
③2min内X的转化率为30%.
④若上述反应中X、Y、Z分别为H2、N2、NH3,且已知17g氨气分解成氮气和氢气要吸收46kJ热量,则该反应的热化学反应方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol.
 化学反应速率和限度与生产、生活密切相关.
化学反应速率和限度与生产、生活密切相关.(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(累计值):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率0.025mol/(L•min)(设溶液体积不变).
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是CD.
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图.
①该反应的化学方程式是3X+Y?2Z.
②该反应达到平衡状态的标志是CD
A.X、Y、Z的反应速率相等
B.X、Y的反应速率比为3:1
C.容器内气体压强保持不变
D.生成1mol Y的同时生成2mol Z
③2min内X的转化率为30%.
④若上述反应中X、Y、Z分别为H2、N2、NH3,且已知17g氨气分解成氮气和氢气要吸收46kJ热量,则该反应的热化学反应方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol.
19. 尿素是首个由无机物人工合成的有机物.工业上尿素由CO2和NH3在一定条件下合成,当氨碳比n(NH3)/n(CO2)=4,CO2的转化率随时间的变化关系如图所示,则A点的逆反应速率v逆(CO2)与B点的正反应速率v正(CO2)的大小关系为( )
尿素是首个由无机物人工合成的有机物.工业上尿素由CO2和NH3在一定条件下合成,当氨碳比n(NH3)/n(CO2)=4,CO2的转化率随时间的变化关系如图所示,则A点的逆反应速率v逆(CO2)与B点的正反应速率v正(CO2)的大小关系为( )
 尿素是首个由无机物人工合成的有机物.工业上尿素由CO2和NH3在一定条件下合成,当氨碳比n(NH3)/n(CO2)=4,CO2的转化率随时间的变化关系如图所示,则A点的逆反应速率v逆(CO2)与B点的正反应速率v正(CO2)的大小关系为( )
尿素是首个由无机物人工合成的有机物.工业上尿素由CO2和NH3在一定条件下合成,当氨碳比n(NH3)/n(CO2)=4,CO2的转化率随时间的变化关系如图所示,则A点的逆反应速率v逆(CO2)与B点的正反应速率v正(CO2)的大小关系为( )| A. | v逆(CO2)>v正(CO2) | B. | v逆(CO2)<v正(CO2) | C. | v逆(CO2)=v正(CO2) | D. | 无法判断 |
13.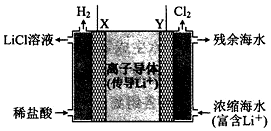 浓差电池中的电动势是由于电池中存在浓度差而产生的.某浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能.下列有关该电池的说法错误的是( )
浓差电池中的电动势是由于电池中存在浓度差而产生的.某浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能.下列有关该电池的说法错误的是( )
 浓差电池中的电动势是由于电池中存在浓度差而产生的.某浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能.下列有关该电池的说法错误的是( )
浓差电池中的电动势是由于电池中存在浓度差而产生的.某浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能.下列有关该电池的说法错误的是( )| A. | 电池工作时,Li+通过离子电子导体移向b区 | |
| B. | 电流由X极通过外电路移向Y极 | |
| C. | 正极发生的反应为:2H++2e-=H2↑ | |
| D. | Y极每生成1 mol Cl2,a区得到2 mol LiCl |
20.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 常温常压下,14 g丙烯和环丙烷混合气体中碳原子数为NA | |
| B. | 标准状况下,11.2 L乙烷含有共价键数为3NA | |
| C. | 密闭容器中充入1 mol I2(g)和2 mol H2(g)充分反应,生成HI分子数为2NA | |
| D. | Na2O2与CO2反应时,生成0.5 mol O2转移的电子数为2NA |
17.化学与生产生活密切相关,下列有关说法不正确的是( )
| A. | 为了防止白色污染应将废旧塑料加以焚烧 | |
| B. | 加热能杀死H7N9禽流感病毒是因为病毒的蛋白质受热变性 | |
| C. | 富脂禽品包装中常放入活性铁粉袋,以防止油脂氧化变质 | |
| D. | 用K2FeO4代替Cl2处理饮用水时,既有杀菌消毒作用,又有净水作用 |
20.下列热化学方程式中的反应热能表示燃烧热的是( )
| A. | NH3(g)+O2(g)=NO(g)+H2O(g)△H=-akJ•mol-1 | |
| B. | C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H=-bkJ•mol-1 | |
| C. | 2CO(g)+O2(g)=2CO2(g)△H=-ckJ•mol-1 | |
| D. | CH3CH2OH(l)+$\frac{1}{2}$O2(g)=CH3CHO(l)+H2O(l)△H=-dkJ•mol-1 |
 如图所示的装置在实验室中用途比较广泛:
如图所示的装置在实验室中用途比较广泛: