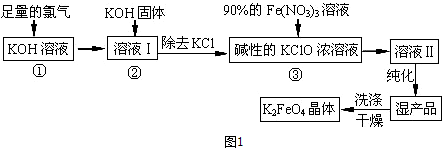
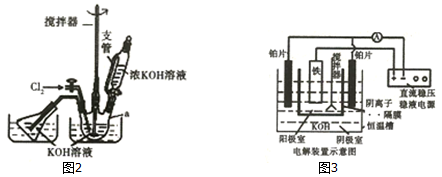
题目内容
20.下列热化学方程式中的反应热能表示燃烧热的是( )| A. | NH3(g)+O2(g)=NO(g)+H2O(g)△H=-akJ•mol-1 | |
| B. | C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H=-bkJ•mol-1 | |
| C. | 2CO(g)+O2(g)=2CO2(g)△H=-ckJ•mol-1 | |
| D. | CH3CH2OH(l)+$\frac{1}{2}$O2(g)=CH3CHO(l)+H2O(l)△H=-dkJ•mol-1 |
分析 从燃烧热的定义分析,燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量.
解答 解:A、燃烧热要求可燃物必须生成是稳定的氧化物,即NH3(g)完全燃烧生成稳定的氧化物应为氮气和液态水,所以热化学方程式中△H不等于燃烧热,故A错误;
B、燃烧热要求可燃物的物质的量必须为1mol,得到的氧化物必须是稳定的氧化物,热化学方程式中△H代表燃烧热,故B正确;
C、热化学方程式中CO的物质的量不为1mol,热化学方程式中△H不等于燃烧热,故C错误;
D、燃烧热要求可燃物必须生成是稳定的氧化物,即CH3CH2OH(l)燃烧生成二氧化碳和液态水,所以热化学方程式中△H不等于燃烧热,故D错误.
故选B.
点评 本题考查燃烧热的定义,题目难度不大,注意燃烧热概念的理解.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
8.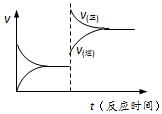 已知:
已知:
①4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H1=-905.5kJ•molˉ1
②N2(g)+O2(g)?2NO(g)△H2
一定条件下,NO可以与NH3反应转化为无害的物质,反应如下:
③4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H3=-1625.5 kJ•molˉ1下列说法正确的是( )
 已知:
已知:①4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H1=-905.5kJ•molˉ1
②N2(g)+O2(g)?2NO(g)△H2
一定条件下,NO可以与NH3反应转化为无害的物质,反应如下:
③4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H3=-1625.5 kJ•molˉ1下列说法正确的是( )
| A. | 反应①使用催化剂,△H1减小 | |
| B. | 反应②生成物总能量低于反应物总能量 | |
| C. | 反应③一定能自发进行 | |
| D. | 反应③达到平衡后升高温度,v(正)、v(逆)的变化如图所示 |
11.根据下列框图分析,下列说法不正确的是( )


| A. | E3+的氧化性比M2+的氧化性强 | |
| B. | 在反应①中硫酸既表现了酸性、又表现了氧化性 | |
| C. | 我国是世界上最早使用反应②冶炼金属M的国家 | |
| D. | 在③反应中若不加稀硫酸可能看到红褐色沉淀 |
15. 25℃时,FeS和ZnS的饱和溶液中,金属阳离子与S2-的物质的量浓度的负对数关系如图所示.下列说法正确的是( )
25℃时,FeS和ZnS的饱和溶液中,金属阳离子与S2-的物质的量浓度的负对数关系如图所示.下列说法正确的是( )
 25℃时,FeS和ZnS的饱和溶液中,金属阳离子与S2-的物质的量浓度的负对数关系如图所示.下列说法正确的是( )
25℃时,FeS和ZnS的饱和溶液中,金属阳离子与S2-的物质的量浓度的负对数关系如图所示.下列说法正确的是( )| A. | 溶解度S(FeS)<S(ZnS) | |
| B. | a点表示FeS的不饱和溶液,且c(Fe2+)>c(S2-) | |
| C. | 向b点对应溶液中加入Na2S溶液,可转化为c点对应的溶液 | |
| D. | 向c点对应的溶液中加入Na2S溶液,ZnS的KSP增大 |
5.下列物质中含有共价键的离子化合物是( )
| A. | CaCl2 | B. | NH4HCO3 | C. | Na2O | D. | H2O2 |
12.a、b、c、d为四种短周期元素,a的原子M电子层有l个电子,b是地壳中含量最多的金属元素,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c.关于这四种元素下列叙述错误的是( )
| A. | a、c、d均存在两种以上的氧化物 | |
| B. | b的氧化物与d的最高价氧化物对应水化物反应后的溶液呈酸性 | |
| C. | a是短周期中金属性最强的元素 | |
| D. | 工业上是通过电解b、d形成的化合物制取b单质 |
10.下列物质的用途中利用了其还原性的是( )
| A. | 用葡萄糖制镜或保温瓶胆 | B. | 用Na2S除去废水中的Hg2+ | ||
| C. | Na2O2作供氧剂 | D. | SO2漂白织物 |
 ; B、C、E离子半径的由大到小的顺序为Cl->O2->Na+;(用离子符号回答) A、B气态氢化物沸点更高的是H2O;
; B、C、E离子半径的由大到小的顺序为Cl->O2->Na+;(用离子符号回答) A、B气态氢化物沸点更高的是H2O;