题目内容
9.某研究性学习小组为了研究影响化学反应速率的因素,设计如下方案:| 实验编号 | 0.01mol•L-1酸性KMnO4溶液 | 0.1mol•L-1H2C2O4溶液 | 水 | 1mol•L-1MnSO4溶液 | 反应温度/℃ | 反应时间 |
| Ⅰ | 2mL | 2mL | 0 | 0 | 20 | 125 |
| Ⅱ | V1 mL | V2 mL | 1mL | 0 | 20 | 320 |
| Ⅲ | V3 mL | V4 mL | V5mL | 0 | 50 | 30 |
| Ⅳ | 2mL | 2mL | 0 | 2滴 | 20 | 10 |
(1)实验记时方法是从溶液混合开始记时,至紫红色刚好褪去时记时结束.
(2)实验I和Ⅱ研究浓度对反应速率的影响,实验Ⅰ和Ⅲ研究温度对反应速率的影响.则
V1=2V2=1V3=2V4=2V5=0.
(3)从实验数据分析,实验I和IV研究催化剂对反应的影响.
(4)请配平上面的化学方程式:
2KMnO4+5H2C2O4+ 3H2SO4= 1K2SO4+ 2MnSO4+10CO2↑+8H2O.
分析 (1)利用高锰酸钾的颜色来判断;
(2)实验I和II研究浓度对反应速率的影响,温度相同,浓度不同;实验I和III研究温度对反应速率的影响,浓度相同中,温度不同;
(3)实验I和实验IV对比,其他条件相同,实验IV加入MnSO4溶液为催化剂;
(4)该反应中Mn元素化合价由+7价变为+2价、C元素化合价由+3价变为+4价,根据转移电子守恒、原子守恒配平方程式.
解答 解:(1)实验计时方法是从溶液混合开始记时,到紫红色刚好褪去计时结束,故答案为:紫红色刚好褪去;
(2)根据实验目的,选择合理数据:高锰酸钾本身作为指示剂,浓度不变,都是2mL,V1=2mL,V3=2mL;实验I和II研究浓度对反应速率的影响,用水来控制溶液的总体积相同,所以草酸体积V2=1mL;实验I和III研究温度对反应速率的影响,浓度全部相同,V4=2mL,V5=0mL,
故答案为:2;1;2;2;0;
(3)从实验数据分析,实验I和实验IV对比,其他条件相同,实验IV加入MnSO4后反应速率加快,所以MnSO4溶液在反应中为催化剂,故答案为:催化剂;
(4)该反应中Mn元素化合价由+7价变为+2价、C元素化合价由+3价变为+4价,其转移电子总数为10,根据转移电子守恒知,KMnO4的计量数是2、H2C2O4的计量数是5,再根据原子守恒得方程式为2KMnO4+5H2C2O4+3H2SO4═1K2SO4+10CO2↑+2MnSO4+8H2O,
故答案为:2;5;3;1;2;10;8.
点评 本题考查影响化学反应速率的因素、氧化还原反应的配平,需要认真分析题中信息,得出合理结论,本题难度中等.

练习册系列答案
相关题目
20. 如图为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述中,不正确的是( )
如图为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述中,不正确的是( )
 如图为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述中,不正确的是( )
如图为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述中,不正确的是( )| A. | 向a试管中先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,再加冰醋酸 | |
| B. | 试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象 | |
| C. | 实验时试管b中饱和Na2CO3溶液的作用是吸收乙醇、中和乙酸及降低乙酸乙酯的溶解度便于分层 | |
| D. | 长玻璃导管只有导气的作用 |
4.电子工业中,常用氯化铁溶液作为印刷电路铜板蚀刻液.请按要求回答下列问题:
(1)若向氯化铁溶液中加入一定量的澄清石灰水,调节溶液pH,可得红褐色沉淀,该反应的离子方程式为:Fe3++3OH-=Fe(OH)3↓,该过程中调节溶液的pH为5,则c(Fe3+)为:4.0×10-11mol•L-1.(己知:Ksp[Fe(OH)3]=4.0×10-38)
(2)某探究小组设计如下线路处理废液和资源回收:
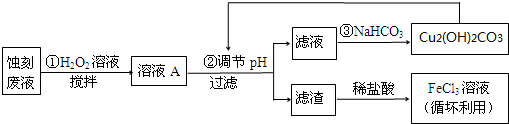
①用足量FeCl3溶液蚀刻铜板后的废液中含有的金属阳离子有:Fe3+、Fe2+和Cu2+.
②FeCl3蚀刻液中通常加入一定量的盐酸,其中加入盐酸的目的是:抑制氯化铁水解.
③步骤①中加入H2O2溶液的目的是:因为将Fe2+氧化成Fe3+,方便后续沉淀时除去.
④已知:生成氢氧化物沉淀的pH
根据表中数据推测调节pH的范围是:[3.2,4.7)或3.2≤pH<4.7.
⑤写出步骤②中生成CO2的离子方程式:4H++Cu2(OH)2CO3 =3H2O+2 Cu2++CO2↑(已知Cu2(OH)2CO3难溶于水)
(1)若向氯化铁溶液中加入一定量的澄清石灰水,调节溶液pH,可得红褐色沉淀,该反应的离子方程式为:Fe3++3OH-=Fe(OH)3↓,该过程中调节溶液的pH为5,则c(Fe3+)为:4.0×10-11mol•L-1.(己知:Ksp[Fe(OH)3]=4.0×10-38)
(2)某探究小组设计如下线路处理废液和资源回收:

①用足量FeCl3溶液蚀刻铜板后的废液中含有的金属阳离子有:Fe3+、Fe2+和Cu2+.
②FeCl3蚀刻液中通常加入一定量的盐酸,其中加入盐酸的目的是:抑制氯化铁水解.
③步骤①中加入H2O2溶液的目的是:因为将Fe2+氧化成Fe3+,方便后续沉淀时除去.
④已知:生成氢氧化物沉淀的pH
| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.2 |
⑤写出步骤②中生成CO2的离子方程式:4H++Cu2(OH)2CO3 =3H2O+2 Cu2++CO2↑(已知Cu2(OH)2CO3难溶于水)
14.为除去粗盐中的泥沙、CaCl2、MgCl2、Na2SO4得到NaCl,可将粗盐溶解于水,然后进行下列五项操作:①过滤 ②加适量盐酸 ③加过量Na2CO3溶液 ④加过量NaOH溶液 ⑤加过量BaCl2溶液 ⑥蒸发,正确的操作顺序是( )
| A. | ①④⑤③②⑥ | B. | ④①③⑤②⑥ | C. | ⑤④③①②⑥ | D. | ③④⑤①②⑥ |
 .
.