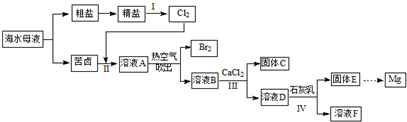
��Ŀ����
19���ơ��صĵ⻯���������Ϳ�ѧʵ������ʮ����Ҫ��Ӧ�ã���ҵ���õ⡢NaOH����мΪԭ�Ͽ������⻯�ƣ��������������£�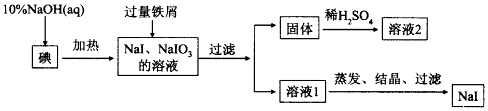
��1���������ڱ��е�λ��Ϊ�������ڡ��ڢ�A�壮
��2��NaOH��Һ�͵ⷴӦʱ��Ҫ�ϸ�����¶ȣ�����¶ȹ��ͣ������ɵ�ĵͼ۸���ƷNaIO����NaOH��Һ�͵ⷴӦʱ������Һ��IO3-��IO--�����ʵ���֮��Ϊ1��1������ɸ÷�Ӧ�����ӷ���ʽ����ƽ
4I2+8OH-=1IO3-+1IO-+6I-+4H2O
��3�����������м��������м��Ŀ���ǽ�NaIO3��ȫת��ΪNaI���������ù����г�ʣ����м�⣬���к��ɫ���壬�������мʱ������Ӧ�Ļ�ѧ����ʽ��3H2O+2Fe+NaIO3=NaI+2Fe��OH��3����
��4����Һ2�г�����H+�⣬һ�����е���������Fe2+��
��5����֪I-�ױ������е�O2�����������Һ1�л��NaI����IJ�������������Ũ������ȴ�ᾧ�����ˣ�
���� ���Ʊ����̿�֪������NaOH��Һ��Ӧ����NaI��NaIO3������Fe��NaIO3����������ԭ��Ӧ����NaI�����������������˺�õ����ɫ�����������������˺���Һ����Ҫ��NaI�����롢�ᴿ�õ�NaI��
��1��������λ��ͬһ���壬������5�����Ӳ㣻
��2������IO3-��IO-��IԪ�صĻ��ϼ۾����ߣ�������NaI����ϵ��ӡ�����غ������
��3��Fe��NaIO3����������ԭ��Ӧ��
��4������Һ��H+��������ȫ�ܽ⣬Fe����������Ӧ��������������
��5�����������ķ����õ����壮
��� �⣺�� l �������������������Ϊ7��5�����Ӳ㣬��λ�����ڱ��������ڡ��ڢ�A�壬�ʴ�Ϊ���������ڡ��ڢ�A�壻
��2��NaOH��Һ�͵ⷴӦʱ������Һ��IO3-��IO-�����ʵ���֮��Ϊ1��1������Ϊ1mol���ɵ����غ��֪������I-Ϊ$\frac{1��5+1��1}{��1-0��}$=6mol����ϵ���غ㼰ԭ���غ��֪���ӷ�ӦΪ4I2+8OH-=IO3-+IO-+6I-+4H2O��
�ʴ�Ϊ��4��8��l��l��6��4��
��3�����������м��Ŀ���ǽ�NaIO3��ȫת��ΪNaI��������мʱ������Ӧ�Ļ�ѧ����ʽΪ3H2O+2Fe+NaIO3=NaI+2Fe��OH��3����
�ʴ�Ϊ����NaIO3��ȫת��ΪNaI��3H2O+2Fe+NaIO3=NaI+2Fe��OH��3����
��4�������г�ʣ����м�⣬���к��ɫ���壬������õ���Һ2������H+�⣬������ȫ�ܽ⣬һ�����е���������Fe2+��
�ʴ�Ϊ��Fe2+��
��5������Һ�л�þ��壬�ɽ���Һ��������Ũ����Ȼ����ȴ�ᾧ�����˵õ����壬�ʴ�Ϊ������Ũ������ȴ�ᾧ��
���� ���⿼���Ʊ�ʵ�鷽������ƣ�Ϊ��Ƶ���㣬�����Ʊ������еķ�Ӧ��������ԭ��Ӧ�ķ����������غ�ļ����Ϊ���Ĺؼ������ط�����Ӧ�������Ŀ��飬�ۺ��Խ�ǿ����Ŀ�Ѷ��еȣ�

| ʵ���� | 0.01mol•L-1����KMnO4��Һ | 0.1mol•L-1H2C2O4��Һ | ˮ | 1mol•L-1MnSO4��Һ | ��Ӧ�¶�/�� | ��Ӧʱ�� |
| �� | 2mL | 2mL | 0 | 0 | 20 | 125 |
| �� | V1 mL | V2 mL | 1mL | 0 | 20 | 320 |
| �� | V3 mL | V4 mL | V5mL | 0 | 50 | 30 |
| �� | 2mL | 2mL | 0 | 2�� | 20 | 10 |
��1��ʵ���ʱ�����Ǵ���Һ��Ͽ�ʼ��ʱ�����Ϻ�ɫ�պ���ȥʱ��ʱ������
��2��ʵ��I�͢��о�Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죬ʵ���͢��о��¶ȶԷ�Ӧ���ʵ�Ӱ�죮��
V1=2V2=1V3=2V4=2V5=0��
��3����ʵ�����ݷ�����ʵ��I��IV�о������Է�Ӧ��Ӱ�죮
��4������ƽ����Ļ�ѧ����ʽ��
2KMnO4+5H2C2O4+ 3H2SO4= 1K2SO4+ 2MnSO4+10CO2��+8H2O��

| A�� | ���� | B�� | ���� | C�� | ������̼ | D�� | ϡ������ |
| ʵ����� | �� | �� | �� | �� |
| ���������mL�� | 30.0 | 30.0 | 30.0 | 30.0 |
| ��Ʒ������g�� | 2.96 | 3.70 | 5.18 | 6.66 |
| CO2�������mL�� | 672 | 840 | 896 | 672 |
��2����������ʵ���Ũ��c��HCl��=2.5mol/L��
| A�� | c��H+�� | B�� | Ka��HF�� | C�� | $\frac{c��{H}^{+}��}{c��O{H}^{-}��}$ | D�� | $\frac{c��{H}^{+}��}{c��HF��}$ |
������Ca��OH��2Ͷ�����NaHCO3��Һ��
�ڹ���NaOH��Һ��������Һ���
�۽�����Ͷ�뵽FeCl2��
����NaAlO2��Һ��ͨ�����CO2
����Na2CO3��Һ��ͨ�����CO2��
| A�� | �٢ڢۢܢ� | B�� | ֻ�Т٢ܢ� | C�� | ֻ�Тڢ� | D�� | ֻ�Тۢ� |
| A�� | ��A��ʾ�ķ�Ӧ������0.8mol/��L•min�� | |
| B�� | 2minĩʱ�ķ�Ӧ���ʣ���B��ʾΪ0.6mol/��L•min�� | |
| C�� | ��C��ʾ�ķ�Ӧ������0.4mol/��L•min�� | |
| D�� | ����D��ʾ��Ӧ������0.8mol/��L•min������x=2 |

 ��ʵ�����������ж�����ϡ�����Ũ�ȿ���Ҫ��Ƚϸߣ�ͨ���ñ�����������Һ���ζ����ζ����������÷�̪��ָʾ�����յ���������Һ����ɫ��ɺ�ɫ����dz��ɫ�����Ұ�����ڲ���ɫ������ͼ�л����ζ���������Һ��pH�����μ�����������Һ����ı仯������ͼ��Ҫ���A�㣩��
��ʵ�����������ж�����ϡ�����Ũ�ȿ���Ҫ��Ƚϸߣ�ͨ���ñ�����������Һ���ζ����ζ����������÷�̪��ָʾ�����յ���������Һ����ɫ��ɺ�ɫ����dz��ɫ�����Ұ�����ڲ���ɫ������ͼ�л����ζ���������Һ��pH�����μ�����������Һ����ı仯������ͼ��Ҫ���A�㣩�� ��
��