题目内容
下表是元素周期表的一部分.表中所列的字母分别代表某一化学元素.
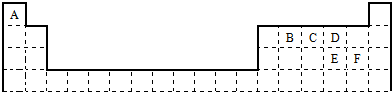
(1)B和F的最高价氧化物对应的水化物中酸性较强的是 (填化学式),写出可以验证该结论的一个离子反应方程式 ;
(2)王水可溶解不能与硝酸反应的金属如Au、Pt等,其原因是王水中不仅含有HNO3,还有反应生成的Cl2和NOCl,假设NOCl中所有原子都达到了8电子稳定结构,试写出NOCl的电子式 ;
(3)EBC-和A2D2反应生成了ED42-和可参加大气循环的两种无毒无害气体,试写出该反应的离子方程式 .

(1)B和F的最高价氧化物对应的水化物中酸性较强的是
(2)王水可溶解不能与硝酸反应的金属如Au、Pt等,其原因是王水中不仅含有HNO3,还有反应生成的Cl2和NOCl,假设NOCl中所有原子都达到了8电子稳定结构,试写出NOCl的电子式
(3)EBC-和A2D2反应生成了ED42-和可参加大气循环的两种无毒无害气体,试写出该反应的离子方程式
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中的位置可知,A为氢元素,B为碳元素,C为氮元素,D为氧元素,E为硫元素,F为Cl元素,据此解答各小题即可.
解答:
解:依据元素周期表可知:A为氢元素,B为碳元素,C为氮元素,D为氧元素,E为硫元素,F为Cl元素,
(1)元素的非金属性越强,其最高价氧化物的水化物的酸性越强,由于非金属性Cl>C,故HClO4酸性强于H2CO3,依据高氯酸可以与碳酸盐反应产生碳酸即可,离子反应方程式为:CO32-+2H+=CO2↑+H2O或HCO3-+H+=CO2↑+H2O,故答案为:HClO4;CO32-+2H+=CO2↑+H2O或HCO3-+H+=CO2↑+H2O;
(2)由于NOCl中所有原子都达到了8电子稳定结构,即N形成3对共价键,O形成2对共价键,Cl形成1对共价键,即电子式为: ,
,
故答案为: ;
;
(3)EBC-为SCN-,A2D2为H2O2,两者反应生成对大气无污染的气体,N的产物应是氮气,C的产物应是二氧化碳,S的产物是硫酸根,离子反应方程式为:2SCN-+11H2O2=2SO42-+2CO2↑+N2↑+10H2O+2H+,
故答案为:2SCN-+11H2O2=2SO42-+2CO2↑+N2↑+10H2O+2H+.
(1)元素的非金属性越强,其最高价氧化物的水化物的酸性越强,由于非金属性Cl>C,故HClO4酸性强于H2CO3,依据高氯酸可以与碳酸盐反应产生碳酸即可,离子反应方程式为:CO32-+2H+=CO2↑+H2O或HCO3-+H+=CO2↑+H2O,故答案为:HClO4;CO32-+2H+=CO2↑+H2O或HCO3-+H+=CO2↑+H2O;
(2)由于NOCl中所有原子都达到了8电子稳定结构,即N形成3对共价键,O形成2对共价键,Cl形成1对共价键,即电子式为:
 ,
,故答案为:
 ;
;(3)EBC-为SCN-,A2D2为H2O2,两者反应生成对大气无污染的气体,N的产物应是氮气,C的产物应是二氧化碳,S的产物是硫酸根,离子反应方程式为:2SCN-+11H2O2=2SO42-+2CO2↑+N2↑+10H2O+2H+,
故答案为:2SCN-+11H2O2=2SO42-+2CO2↑+N2↑+10H2O+2H+.
点评:本题主要考查的是元素周期律的应用以及离子反应方程式的书写、酸性强弱判断、电子式书写等,综合性较强.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
我们可以用水解度来表示盐水解程度的大小,它是用已水解的物质的量占原来总的电解质物质的量的分数来表示的.若测得2L 0.1mol/L的强碱弱酸盐NaA溶液的常温下的pH为10,则A-的水解度为( )
| A、0.01% | B、0.1% |
| C、0.2% | D、1% |
一定质量的A1、Mg合金与适量的稀硫酸恰好完全反应,将反应后的溶液蒸干,所得固体(不含结晶水)质量比原固体增加了4.8g,则该合金的物质的量可能为( )
| A、0.04mol |
| B、0.05mol |
| C、0.06mol |
| D、0.07mol |
下列有关工业生产的叙述正确的是( )
| A、合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B、电镀时,常采用镀层金属作阳极,含镀层金属阳离子的溶液作电解质溶液 |
| C、电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的C12进入阳极室 |
| D、电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小 |
在pH=1的无色溶液中能大量共存的离子组是( )
| A、NH4+、Mg2+、SO42-、Cl- |
| B、Ba2+、K+、OH-、NO3- |
| C、Al3+、Cu2+、SO42-、Cl- |
| D、Na+、Ca2+、Cl-、CO32- |
常温下0.1mol/L某一元酸(HA)溶液中
=10-8,下列叙述正确的是( )
| c(OH-) |
| c(H+) |
| A、溶液中水电离出的c(H+)=10-10mol/L |
| B、溶液中c(HA)+c(A-)=0.1mol/L |
| C、与0.05mol/LNaOH溶液等体积混合所得溶液中离子浓度大小关系为c(H+)<c(OH-)<c(Na+)<c(A-) |
| D、上述溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)减小 |
关于下列四个图象的说法正确的是( )
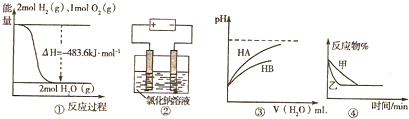

| A、图①表示H2与O2发生反应过程中的能量变化,H2的燃烧热为241.8kJ?mol-1 |
| B、图②是在电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定为1:1 |
| C、图③表示常温下稀释 HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液 |
| D、图④表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(g) 的影响,乙的压强大 |
 某课外兴趣小组利用如图装置探究甲烷与氯气的反应.根据题意,回答下列问题:
某课外兴趣小组利用如图装置探究甲烷与氯气的反应.根据题意,回答下列问题: