题目内容
关于下列四个图象的说法正确的是( )
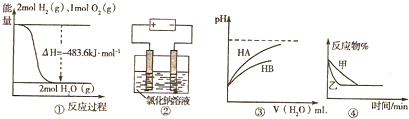

| A、图①表示H2与O2发生反应过程中的能量变化,H2的燃烧热为241.8kJ?mol-1 |
| B、图②是在电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定为1:1 |
| C、图③表示常温下稀释 HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液 |
| D、图④表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(g) 的影响,乙的压强大 |
考点:反应热和焓变,化学平衡的影响因素,弱电解质在水溶液中的电离平衡,电解原理
专题:图示题
分析:A、燃烧热是1mol可燃物完全反应生成稳定氧化物放出的热量;
B、图②电解氯化钠稀溶液,阳极开始生成Cl2,之后生成O2;
C、酸性越弱对应盐的水解显碱性,水解程度越大,溶液pH越大;
D、对应反应前后气体体积不变的反应,改变压强化学平衡不移动.
B、图②电解氯化钠稀溶液,阳极开始生成Cl2,之后生成O2;
C、酸性越弱对应盐的水解显碱性,水解程度越大,溶液pH越大;
D、对应反应前后气体体积不变的反应,改变压强化学平衡不移动.
解答:
解:A、图象中1mol氢气完全燃烧生成的是水蒸气时放热241.8kJ,不是氢气的燃烧热,故A错误;
B.图②电解氯化钠稀溶液,阳极开始生成Cl2,之后生成O2,如点解时间较长,则阴、阳极产生气体体积之比大于1:1,故B错误;
C.依据图象乙,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化HA溶液PH变化大,酸性HA>HB,则同浓度的钠盐,水解程度:NaA<NaB,所以同浓度的NaA溶液的pH小于NaB溶液,故C正确;
D.图④中可逆反应2A(g)+2B(g)?3C(g)+D(g) 的反应前后气体体积不变,增大压强化学平衡不移动,平衡是生成物的含量不变,增大压强缩短了达到平衡的时间,所以乙的压强大,则图④符合,故D正确.
故选CD.
B.图②电解氯化钠稀溶液,阳极开始生成Cl2,之后生成O2,如点解时间较长,则阴、阳极产生气体体积之比大于1:1,故B错误;
C.依据图象乙,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化HA溶液PH变化大,酸性HA>HB,则同浓度的钠盐,水解程度:NaA<NaB,所以同浓度的NaA溶液的pH小于NaB溶液,故C正确;
D.图④中可逆反应2A(g)+2B(g)?3C(g)+D(g) 的反应前后气体体积不变,增大压强化学平衡不移动,平衡是生成物的含量不变,增大压强缩短了达到平衡的时间,所以乙的压强大,则图④符合,故D正确.
故选CD.
点评:本题考查了图象分析判断能力,涉及的知识点较多,题目较为综合,题目难度中等,易错点为B,注意点解氯化钠稀溶液的特点,正确判断两极反应是解答该题的关键.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
一些烷烃的燃烧热如下表:下列表述正确的是( )
| 化合物 | 燃烧热/kJ?mol-1 | 化合物 | 燃烧热/kJ?mol-1 |
| 甲烷 | 891.0 | 正丁烷 | 2878.0 |
| 乙烷 | 1560.8 | 异丁烷 | 2869.6 |
| 丙烷 | 2221.5 | 2-甲基丁烷 | 3531.3 |
| A、正戊烷的燃烧热大约在3520 kJ?mol-1左右 |
| B、热稳定性:正丁烷<异丁烷 |
| C、乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g);△H=-1560.8kJ?mol-1 |
| D、相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多 |
下列关于醇与酚的比较中正确的是( )
| A、醇和酚都能与氢氧化钠溶液反应 |
| B、醇和酚都能与钠发生反应 |
| C、醇、酚的水溶液都能使石蕊试纸变红 |
| D、醇和酚都能与碳酸钠溶液反应 |
硝酸参加下列反应,既体现出酸性,又体现出氧化性的是( )
| A、Cu |
| B、Fe2O3 |
| C、C |
| D、NaOH |
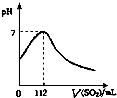 在标准状况下,向100mL氢硫酸溶液中通入二氧化硫气体,溶液pH变化如图所示,则原氢硫酸溶液的物质的量浓度为( )
在标准状况下,向100mL氢硫酸溶液中通入二氧化硫气体,溶液pH变化如图所示,则原氢硫酸溶液的物质的量浓度为( )| A、0.5 mol?L─1 |
| B、0.05 mol?L─1 |
| C、1 mol?L─1 |
| D、0.1 mol?L─1 |
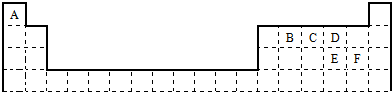
 的名称是
的名称是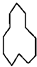 名称是
名称是 其名称是
其名称是