题目内容
常温下0.1mol/L某一元酸(HA)溶液中
=10-8,下列叙述正确的是( )
| c(OH-) |
| c(H+) |
| A、溶液中水电离出的c(H+)=10-10mol/L |
| B、溶液中c(HA)+c(A-)=0.1mol/L |
| C、与0.05mol/LNaOH溶液等体积混合所得溶液中离子浓度大小关系为c(H+)<c(OH-)<c(Na+)<c(A-) |
| D、上述溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)减小 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:常温下0.1mol/L某一元酸(HA)溶液中
=10-8,c(H+)×c(OH-)=10-14可知,溶液中
=108,则
=108,解得c(H+)=0.001mol/L,则HA为弱酸;
A、溶液中水电离出的c(H+)水=c(OH-)水;
B、根据物料守恒分析;
C、0.1mol/L某一元酸(HA)浓度与0.05mol/LNaOH溶液等体积混合生成0.025mol?L-1的HA和0.025mol?L-1的NaA,溶液呈酸性,说明溶液中HA的电离程度大于A-离子的水解程度;
D、HA溶液中加入一定量CH3COONa晶体会消耗氢离子,加水稀释氢离子浓度减小.
| c(OH-) |
| c(H+) |
| ||
| c(OH-) |
| ||
| c(H+) |
A、溶液中水电离出的c(H+)水=c(OH-)水;
B、根据物料守恒分析;
C、0.1mol/L某一元酸(HA)浓度与0.05mol/LNaOH溶液等体积混合生成0.025mol?L-1的HA和0.025mol?L-1的NaA,溶液呈酸性,说明溶液中HA的电离程度大于A-离子的水解程度;
D、HA溶液中加入一定量CH3COONa晶体会消耗氢离子,加水稀释氢离子浓度减小.
解答:
解:常温下0.1mol/L某一元酸(HA)溶液中
=10-8,c(H+)×c(OH-)=10-14可知,溶液中
=108,则
=108,解得c(H+)=0.001mol/L;
A、溶液中c(H+)=0.001mol/L,则c(OH-)=
=10-11mol/L,该溶液中由水电离出的c(H+)=c(OH-)=10-11mol/L,故A错误;
B、0.1mol/L某一元酸(HA)溶液中A元素的总物质的量为0.1mol/L,则c(HA)+c(A-)=0.1mol/L,故B正确;
C、0.1mol/L某一元酸(HA)浓度与0.05mol/LNaOH溶液等体积混合生成0.025mol?L-1的HA和0.025mol?L-1的NaA,溶液中HA的电离程度大于A-离子的水解程度,溶液呈酸性,则c(OH-)<c(H+)<c(Na+)<c(A-),故C错误;
D、HA溶液中加入一定量CH3COONa晶体,CH3COONa水解显碱性,会消耗酸电离的氢离子,氢离子浓度减小,则氢氧根离子浓度增大,加水稀释会促进酸的电离,但是溶液体积增大的程度大于氢离子物质的量增大的程度,所以氢离子浓度减小,则氢氧根离子浓度增大,故D错误.
故选A.
| c(OH-) |
| c(H+) |
| ||
| c(OH-) |
| ||
| c(H+) |
A、溶液中c(H+)=0.001mol/L,则c(OH-)=
| 10-14 |
| 0.001 |
B、0.1mol/L某一元酸(HA)溶液中A元素的总物质的量为0.1mol/L,则c(HA)+c(A-)=0.1mol/L,故B正确;
C、0.1mol/L某一元酸(HA)浓度与0.05mol/LNaOH溶液等体积混合生成0.025mol?L-1的HA和0.025mol?L-1的NaA,溶液中HA的电离程度大于A-离子的水解程度,溶液呈酸性,则c(OH-)<c(H+)<c(Na+)<c(A-),故C错误;
D、HA溶液中加入一定量CH3COONa晶体,CH3COONa水解显碱性,会消耗酸电离的氢离子,氢离子浓度减小,则氢氧根离子浓度增大,加水稀释会促进酸的电离,但是溶液体积增大的程度大于氢离子物质的量增大的程度,所以氢离子浓度减小,则氢氧根离子浓度增大,故D错误.
故选A.
点评:本题考查弱电解质在溶液中的电离,题目难度中等,本题的关键是根据溶液中c(H+)与c(OH-)的比值,结合溶液的离子积常数Kw计算出溶液的c(H+),判断出HA为弱酸.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
A、用铂电极电解氯化镁溶液:Cl-+2H2O
| ||||
| B、NaHSO4溶液中滴人Ba(OH)2溶液至中性:H++SO42-+Ba2+十OH-═BaSO4↓+H2O | ||||
| C、在H2O2中加入酸性KMnO4溶液:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | ||||
| D、稀HNO3中加入过量的Fe粉:Fe十4H+十NO3-═Fe3++NO↑+2H2O |
化学家从反应C2H6(g)+Cl2(g)→C2H5Cl(l)+HCl(g)中受到启发,提出在农药和有机合成工业中可获得副产品盐酸,这一设想已成为现实.试指出从上述反应体系中得到盐酸可采用的分离方法是( )
| A、蒸馏法 | B、水洗法 |
| C、分液法 | D、过滤法 |
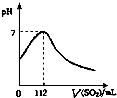 在标准状况下,向100mL氢硫酸溶液中通入二氧化硫气体,溶液pH变化如图所示,则原氢硫酸溶液的物质的量浓度为( )
在标准状况下,向100mL氢硫酸溶液中通入二氧化硫气体,溶液pH变化如图所示,则原氢硫酸溶液的物质的量浓度为( )| A、0.5 mol?L─1 |
| B、0.05 mol?L─1 |
| C、1 mol?L─1 |
| D、0.1 mol?L─1 |
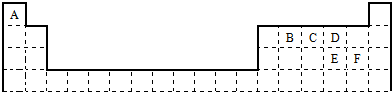
 的名称是
的名称是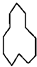 名称是
名称是 其名称是
其名称是