题目内容
20.0.2molCu2S投入一定浓度的含溶质1.6mol的硝酸中,充分反应后溶液蓝色澄清,生成NO与NO2的物质的量之比为1:1,下列说法正确的是( )| A. | Cu2S未溶解完 | |
| B. | 硝酸恰好完全反应 | |
| C. | 实际参加反应的Cu2S与HNO3的物质的量之比为1:7 | |
| D. | 反应的Cu2S与被还原的HNO3的物质的量之比为3:10 |
分析 将0.2mol Cu2S与足量稀HNO3反应,生成Cu(NO3)2、SO42-、NO与NO2和H2O,该反应中Cu元素化合价由+1价变为+2价、S元素化合价由-2价变为6价,所以Cu2S是还原剂、部分硝酸是氧化剂,据此分析解答.
解答 解:将0.2mol Cu2S与足量稀HNO3反应,充分反应后溶液蓝色澄清,所以生成Cu(NO3)2、SO42-、NO与NO2和H2O,该反应中Cu元素化合价由+1价变为+2价、S元素化合价由-2价变为6价,所以Cu2S是还原剂、部分硝酸是氧化剂,
A、如果0.2mol Cu2S完全反应则转移电子的物质的量为:2mol,而酸性的硝酸为0.2×2×2=0.8mol,所以氧化性的硝酸为0.8mol,即生成一氧化氮和二氧化氮的物质的量都是0.4mol,则得电子的物质的量为0.4×(1+3)=2mol,所以两者恰好完全反应,故A错误;
B、由A分析0.2molCu2S投入一定浓度的含溶质1.6mol的硝酸中两者恰好完全反应,故B正确;
C、实际参加反应的Cu2S与HNO3的物质的量之比为0.2:1.6=1:8,故C错误;
D、反应的Cu2S与被还原的HNO3的物质的量之比为0.2:0.8=1:4,故D错误;
故选B.
点评 本题考查氧化还原反应的计算,题目难度中等,注意根据氧化还原反应的电子守恒和质量守恒计算该题.

练习册系列答案
相关题目
11.为了测定K2CO3和NaHCO3混合物的组成,某学生每次称取一定质量的混合物溶于水配成溶液,向其中加入相同浓度的Ba(OH)2溶液,每次实验均充分反应,实验结果记录如下
请回答下列问题:
(1)第二次实验中产生沉淀的质量是2.758g;
(2)混合物中K2CO3和NaHCO3的物质的量之比为5:2.
| 实验次数 | 混合物的质量/g | 所加Ba(OH)2溶液的体积/L | 测得沉淀的质量/g |
| 1 | 0.858 | 0.5 | 1.379 |
| 2 | 1.716 | 0.5 | |
| 3 | 2.574 | 0.5 | 4.137 |
| 4 | 3.432 | 0.5 | 5.516 |
| 5 | 4.290 | 0.5 | 5.516 |
| 6 | 5.148 | 0.5 | 5.516 |
(1)第二次实验中产生沉淀的质量是2.758g;
(2)混合物中K2CO3和NaHCO3的物质的量之比为5:2.
15.Na2CO3、NaHCO3、CaO和NaOH组成的混合物27.2g,溶于足量水并充分反应后,溶液中Ca2+、CO32-、HCO3-全部转化为沉淀,将反应容器内水分蒸干,最后得到白色固体29.0g.则原混合物中Na2CO3的质量是( )
| A. | 10.6 g | B. | 5.3 g | C. | 15.9 g | D. | 5.6 g |
5.据ETH天文研究所报告,组成太阳的气体中存在20Ne和22Ne.下列关于20Ne和22Ne的说法正确的是( )
| A. | 22Ne的质子数为12 | B. | 20Ne和22Ne的中子数相同 | ||
| C. | 20Ne和22Ne的质量数相同 | D. | 20Ne和22Ne互为同位素 |
12.在花瓶中插上一束美丽的鲜花,将会给你紧张而又忙碌的学习、生活带来轻松和愉悦的心情.可是过不了几天,花儿就会枯萎.如果在花瓶中加入“鲜花保鲜剂”,就会延长鲜花的寿命.表是1L“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是A(填字母).
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)“鲜花保鲜剂”中的K+的物质的量浓度约为(阿司匹林中不含K+)8.91×10-3mol/L
(3)配制上述1L“鲜花保鲜剂”所需的仪器有:量筒、烧杯、玻璃棒、托盘天平、药匙、胶头滴管,1000mL容量瓶.(填所缺仪器的名称).
(4)在溶液配制过程中,下列操作对配制结果没有影响的是BD(填字母).
A.定容用胶头滴管加水时,仰视观察溶液凹液面与容量瓶刻度线相切
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(5)实验室用固体加热制氨气的化学反应方程式为:2NH4Cl+Ca(OH)$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
(6)若将收集到的氨气溶于水配成100mL的溶液,所得氨水中NH3物质量浓度(不考虑NH3与H2O的反应)为0.3mol•L-1,则需要氨气的体积为672mL(标准状况).
| 成 分 | 质 量(g) | 摩尔质量(g/mol) |
| 蔗糖 | 50.00 | 342 |
| 硫酸钾 | 0.50 | 174 |
| 阿司匹林 | 0.35 | 180 |
| 高锰酸钾 | 0.50 | 158 |
| 硝酸银 | 0.04 | 170 |
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)“鲜花保鲜剂”中的K+的物质的量浓度约为(阿司匹林中不含K+)8.91×10-3mol/L
(3)配制上述1L“鲜花保鲜剂”所需的仪器有:量筒、烧杯、玻璃棒、托盘天平、药匙、胶头滴管,1000mL容量瓶.(填所缺仪器的名称).
(4)在溶液配制过程中,下列操作对配制结果没有影响的是BD(填字母).
A.定容用胶头滴管加水时,仰视观察溶液凹液面与容量瓶刻度线相切
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(5)实验室用固体加热制氨气的化学反应方程式为:2NH4Cl+Ca(OH)$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
(6)若将收集到的氨气溶于水配成100mL的溶液,所得氨水中NH3物质量浓度(不考虑NH3与H2O的反应)为0.3mol•L-1,则需要氨气的体积为672mL(标准状况).
9.下列有关等电子体的说法正确的是( )
| A. | NO3-和CO32-是等电子体,均为平面三角形结构 | |
| B. | CH4和NH4+是等电子体,键角均为60° | |
| C. | H3O+和PC13是等电子体,均为三角锥形结构 | |
| D. | B3N3H6和苯是等电子体,B3N3H6分子中不存在“肩并肩”式重叠的轨道 |
10.常温下,电解质溶液中的下列关系式不正确的是( )
| A. | 已知A-+H2B(过量)=HA+HB-,则结合H+的能力:HB-<A-<B2- | |
| B. | 在0.1 mol•L-1的氨水中滴加0.1 mol•L-1盐酸,恰好完全中和时,c(NH4+)+c(NH3•H2O)=0.05mol•L-1 | |
| C. | 将c mol•L-1 的醋酸溶液与0.02 mol•L-1NaOH溶液等体积混合后恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=$\frac{2×1{0}^{-9}}{c-0.02}$ | |
| D. | 将0.2mol•L-1盐酸与0.1mol•L-1的KAlO2溶液等体积混合,溶液中离子浓度由大到小的顺序:c(Cl-)>c(K+)>c(Al3+)>c(H+)>c(OH-) |
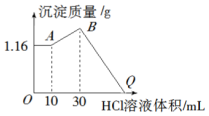 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入1mol•L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示.
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入1mol•L-1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图所示.