题目内容
10.在100ml的盐酸溶液中加入25g 石灰石恰好完全反应,其中杂质不与盐酸反应且不溶于水,共收集气体4.48L(标准状况下).求:(1)参加反应氯化氢的物质的量为多少?
(2)石灰石中碳酸钙的质量分数?
(3)后来溶液的质量比原来盐酸的质量增加了多少?
分析 发生反应:CaCO3+2HCl=CaCl2+CO2↑+H2O,根据方程式计算HCl物质的量、生成二氧化碳物质的量,根据V=nVm计算二氧化碳体积,列关系式进行计算.
解答 解:4.48L的气体的物质的量为:$\frac{4.48L}{22.4L/mol}$=0.2mol,所以参加反应氯化氢的物质的量为0.2×2=0.4mol,石灰石的物质的量为0.2mol,质量为:0.2×100=20g,所以石灰石中碳酸钙的质量分数$\frac{20g}{25g}×100%$=80%,由反应方程式可知有1mol的碳酸钙参加反应溶液质量增加相当于1mol的氧化钙,所以质量增加了0.2×56=11.2g,
答:(1)参加反应氯化氢的物质的量为0.4mol;
(2)石灰石中碳酸钙的质量分数为80%;
(3)后来溶液的质量比原来盐酸的质量增加了11.2g.
点评 本题考查物质的量有关计算,比较基础,旨在考查学生对基础知识的巩固,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
13.900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应:
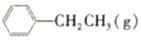 ?
? =CH2(g)+H2(g)
=CH2(g)+H2(g)
经一段时间后达到平衡,反应过程中测定的部分数据如表所示:
下列说法正确的是( )
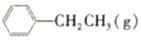 ?
? =CH2(g)+H2(g)
=CH2(g)+H2(g)经一段时间后达到平衡,反应过程中测定的部分数据如表所示:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
| A. | 保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率大于50.0% | |
| B. | 反应在前20分钟的平均速率为v(H2)=0.008molmol/( L•min) | |
| C. | 若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态 | |
| D. | 相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,达到平衡前v正>v逆 |
15.下列各组物质中不起反应的是( )
| A. | SiO2与纯碱共熔 | B. | CO2通入Na2SiO3溶液 | ||
| C. | SiO2与大理石共熔 | D. | SiO2和浓H2SO4共热 |
20.0.2molCu2S投入一定浓度的含溶质1.6mol的硝酸中,充分反应后溶液蓝色澄清,生成NO与NO2的物质的量之比为1:1,下列说法正确的是( )
| A. | Cu2S未溶解完 | |
| B. | 硝酸恰好完全反应 | |
| C. | 实际参加反应的Cu2S与HNO3的物质的量之比为1:7 | |
| D. | 反应的Cu2S与被还原的HNO3的物质的量之比为3:10 |