题目内容
11.为了测定K2CO3和NaHCO3混合物的组成,某学生每次称取一定质量的混合物溶于水配成溶液,向其中加入相同浓度的Ba(OH)2溶液,每次实验均充分反应,实验结果记录如下| 实验次数 | 混合物的质量/g | 所加Ba(OH)2溶液的体积/L | 测得沉淀的质量/g |
| 1 | 0.858 | 0.5 | 1.379 |
| 2 | 1.716 | 0.5 | |
| 3 | 2.574 | 0.5 | 4.137 |
| 4 | 3.432 | 0.5 | 5.516 |
| 5 | 4.290 | 0.5 | 5.516 |
| 6 | 5.148 | 0.5 | 5.516 |
(1)第二次实验中产生沉淀的质量是2.758g;
(2)混合物中K2CO3和NaHCO3的物质的量之比为5:2.
分析 第4次、第5次生成沉淀碳酸钡质量都为5.516g,说明样品质量为3.342g时,氢氧化钡已经完全反应,第1次、第4次样品的质量分别为0.858g、3.432g,第1次、第4次生成沉淀碳酸钡质量分别为1.379g、5.516g,样品的质量之比等于生成的沉淀质量之比为1:4,说明第4次恰好完全反应,
(1)根据第1次与第2次样品之比等于沉淀质量之比,据此计算第2次生成沉淀的质量;
(2)第3次实验中样品完全反应,令碳酸氢钠与碳酸钾的物质的量分别为xmol、ymol,根据碳元素守恒可知沉淀碳酸钡的物质的量为(x+y)mol,根据样品质量与碳酸钡沉淀质量列方程计算;
解答 解:第4次、第5次生成沉淀碳酸钡质量都为5.516g,说明样品质量为3.342g时,氢氧化钡已经完全反应,第1次、第4次样品的质量分别为0.858g、3.432g,第1次、第4次生成沉淀碳酸钡质量分别为1.379g、5.516g,样品的质量之比等于生成的沉淀质量之比为1:4,说明第4次恰好完全反应,
(1)第2次实验中样品完全反应,设产生沉淀质量为mg,则:0.858g:1.716g=1.379g:mg,解得:m=2.758,
故答案为:2.758;
(2)第3次实验中样品完全反应,设碳酸氢钠与碳酸钾的物质的量分别为xmol、ymol,根据碳元素守恒可知沉淀碳酸钡的物质的量为:(x+y)mol,则:84x+138y=2.574g、197x+197y=4.137,
解得:x=0.006,y=0.015,
故样品中K2CO3和NaHCO3的物质的量之比为:0.015mol:0.006mol=5:2,
故答案为:5:2.
点评 本题考查混合物的计算、实验数据分析处理等,综合性较大,根据质量定比关系判断过量问题是解题关键,旨在考查学生的综合能力,是一道不错的能力考查题,题目难度较大.

| A. | Na+、Cu2+、Clˉ、SO42- | B. | Ca2+、K+、CO32ˉ、NO3ˉ | ||
| C. | Na+、H+、Clˉ、CO32ˉ | D. | K+、H+、Fe2+、NO3ˉ |
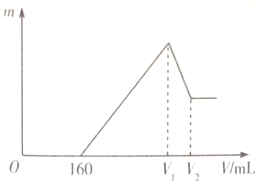 将0.1mol的Mg、Al混合物溶于100mL2mo L•L-1稀硫酸中,然后再滴加1moL•L-1 NaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量(随加入NaOH溶液的体积(V)变化如图所示,当开始出现沉淀(不考虑混合时溶液体积的变化)下列判断正确的是( )
将0.1mol的Mg、Al混合物溶于100mL2mo L•L-1稀硫酸中,然后再滴加1moL•L-1 NaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量(随加入NaOH溶液的体积(V)变化如图所示,当开始出现沉淀(不考虑混合时溶液体积的变化)下列判断正确的是( )| A. | Mg与Al的质量比为3:2 | B. | (V1-160):(V2-V1)=3:1 | ||
| C. | 沉淀质量m最大=3.48 g | D. | V1时:c(Na+)=$\frac{400}{100+{V}_{1}}$mol•L-1 |
| A. | 变深 | B. | 变浅 | C. | 变黄 | D. | 不变 |
| A. | Cu2S未溶解完 | |
| B. | 硝酸恰好完全反应 | |
| C. | 实际参加反应的Cu2S与HNO3的物质的量之比为1:7 | |
| D. | 反应的Cu2S与被还原的HNO3的物质的量之比为3:10 |
 乙烯催化氧化成乙酸可设计成如图所示的燃料电池,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法正确的是( )
乙烯催化氧化成乙酸可设计成如图所示的燃料电池,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法正确的是( )| A. | 该装置能量转化形式是电能转化为化学能 | |
| B. | 负极反应式为:CH2═CH2+2e-+H2O═CH3CHO+2H+ | |
| C. | 每有0.1molO2反应,则向正极迁移的H+的物质的量为0.4mol | |
| D. | 电流方向:电极a→负载→电极b |