题目内容
5.据ETH天文研究所报告,组成太阳的气体中存在20Ne和22Ne.下列关于20Ne和22Ne的说法正确的是( )| A. | 22Ne的质子数为12 | B. | 20Ne和22Ne的中子数相同 | ||
| C. | 20Ne和22Ne的质量数相同 | D. | 20Ne和22Ne互为同位素 |
分析 具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素.元素符号左上角数字为质量数,左下角数字为质子数,中子数=质量数-质子数,原子序数=核电荷数=质子数=核外电子数.
解答 解:A.Ne是10号元素,22Ne的质子数为10,故A错误;
B.20Ne和22Ne的质子数相同都为10,中子数分别为10和12个,故B错误;
C.20Ne和22Ne的质量数分别为20,22,故C错误;
D.20Ne和22Ne所含的质子数相同,中子数不同,互为同位素,故D正确;
故选D.
点评 本题主要考查了同位素,注意这些关系的运用,在原子中,原子序数=核电荷数=质子数=核外电子数,质量数=质子数+中子数.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案
相关题目
15.下列各组物质中不起反应的是( )
| A. | SiO2与纯碱共熔 | B. | CO2通入Na2SiO3溶液 | ||
| C. | SiO2与大理石共熔 | D. | SiO2和浓H2SO4共热 |
16.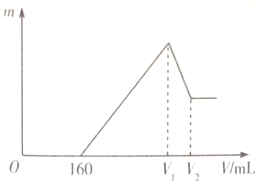 将0.1mol的Mg、Al混合物溶于100mL2mo L•L-1稀硫酸中,然后再滴加1moL•L-1 NaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量(随加入NaOH溶液的体积(V)变化如图所示,当开始出现沉淀(不考虑混合时溶液体积的变化)下列判断正确的是( )
将0.1mol的Mg、Al混合物溶于100mL2mo L•L-1稀硫酸中,然后再滴加1moL•L-1 NaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量(随加入NaOH溶液的体积(V)变化如图所示,当开始出现沉淀(不考虑混合时溶液体积的变化)下列判断正确的是( )
 将0.1mol的Mg、Al混合物溶于100mL2mo L•L-1稀硫酸中,然后再滴加1moL•L-1 NaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量(随加入NaOH溶液的体积(V)变化如图所示,当开始出现沉淀(不考虑混合时溶液体积的变化)下列判断正确的是( )
将0.1mol的Mg、Al混合物溶于100mL2mo L•L-1稀硫酸中,然后再滴加1moL•L-1 NaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量(随加入NaOH溶液的体积(V)变化如图所示,当开始出现沉淀(不考虑混合时溶液体积的变化)下列判断正确的是( )| A. | Mg与Al的质量比为3:2 | B. | (V1-160):(V2-V1)=3:1 | ||
| C. | 沉淀质量m最大=3.48 g | D. | V1时:c(Na+)=$\frac{400}{100+{V}_{1}}$mol•L-1 |
13.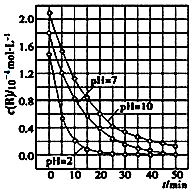 二氧化钛在一定波长光的照射下,可有效降解甲醛、苯等有机物,效果持久,且自身对人体无害.某课题组研究了溶液的酸碱性对TiO2光催化染料R降解反应的影响,结果如图所示.下列判断正确的是( )
二氧化钛在一定波长光的照射下,可有效降解甲醛、苯等有机物,效果持久,且自身对人体无害.某课题组研究了溶液的酸碱性对TiO2光催化染料R降解反应的影响,结果如图所示.下列判断正确的是( )
 二氧化钛在一定波长光的照射下,可有效降解甲醛、苯等有机物,效果持久,且自身对人体无害.某课题组研究了溶液的酸碱性对TiO2光催化染料R降解反应的影响,结果如图所示.下列判断正确的是( )
二氧化钛在一定波长光的照射下,可有效降解甲醛、苯等有机物,效果持久,且自身对人体无害.某课题组研究了溶液的酸碱性对TiO2光催化染料R降解反应的影响,结果如图所示.下列判断正确的是( )| A. | 在0~50 min之间,R的降解百分率pH=2大于pH=7 | |
| B. | 溶液酸性越强,R的降解速率越大 | |
| C. | R的起始浓度不同,无法判断溶液的酸碱性对R的降解速率的影响 | |
| D. | 在20~25 min之间,pH=10时R的降解速率为04mol•L-1•min-1 |
20.0.2molCu2S投入一定浓度的含溶质1.6mol的硝酸中,充分反应后溶液蓝色澄清,生成NO与NO2的物质的量之比为1:1,下列说法正确的是( )
| A. | Cu2S未溶解完 | |
| B. | 硝酸恰好完全反应 | |
| C. | 实际参加反应的Cu2S与HNO3的物质的量之比为1:7 | |
| D. | 反应的Cu2S与被还原的HNO3的物质的量之比为3:10 |
14.称取两份铝粉,第一份加入足量的浓氢氧化钠溶液,第二份加入足量的稀盐酸,如果要放出等体积的气体(在同温同压下),两份铝的质量之比为( )
| A. | 1:2 | B. | 1:3 | C. | 3:2 | D. | 1:1 |
3.设NA为阿伏伽德罗常数的数值.下列说法正确的是( )
| A. | 常温常压下,1.7g NH3所含的电子数为0.8NA | |
| B. | 标准状况下,11.2L SO2所含的氧原子数为1.5NA | |
| C. | 1mol Fe与足量的稀硝酸反应,转移的电子总数为3NA | |
| D. | 0.1mol•L-1的Na2CO3溶液中含有的钠离子数为0.2NA |
 ;
; .
.