题目内容
10.U、V、W、X、Y、Z是原子序数依次增大的六种常见元素.Y的单质在W2中燃烧的产物可使品红溶液褪色.Z和W元素形成的化合物Z3W4具有磁性.U的单质在W2中燃烧可生成UW和UW2两种气体.X的单质是一种金属,该金属单质在UW2中剧烈燃烧生成黑、白两种固体.请回答下列问题:
(1)X在周期表中的位置:第三周期ⅡA族,UW2的电子式为
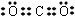 ;
;(2)写出下列反应的化学方程式Z在高温下与水反应3Fe+4 H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2↑;
(3)U、V、W形成的10电子氢化物中,氢化物的稳定性从强到弱的顺序是H2O>NH3>CH4(写化学式),V元素的氢化物极易溶于水的主要原因是NH3与H2O间能形成氢键,该氢化物与空气可以构成一种环保燃料电池,电解质溶液是KOH,其负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
分析 Y的单质在W2中燃烧的产物可使品红溶液褪色,该产物为SO2,则Y为S元素,W为O元素,Z的单质在W中燃烧生成的化合物Z3W4具有磁性,则Z3W4为Fe3O4,Z为Fe元素,U的单质在W2中燃烧可生成UW和UW2两种气体,U原子序数小于O元素,应为CO和CO2气体,U为C元素,X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体,应为Mg和CO2的反应,则X为Mg元素,V的原子序数介于碳、氧之间,则V为N元素,据此解答.
解答 解:Y的单质在W2中燃烧的产物可使品红溶液褪色,该气体为SO2,则Y为S元素,W为O元素,Z的单质在W中燃烧生成的化合物Z3W4具有磁性,则Z3W4为Fe3O4,Z为Fe元素,U的单质在W2中燃烧可生成UW和UW2两种气体,U原子序数小于O元素,应为CO和CO2气体,U为C元素,X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体,应为Mg和CO2的反应,则X为Mg元素,V的原子序数介于碳、氧之间,则V为N元素.
(1)X为Mg元素,处于周期表中第三周期ⅡA族,UW2为CO2,电子式为 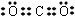 ,
,
故答案为:第三周期ⅡA族;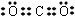 ;
;
(2)Fe单质与水蒸气反应生成四氧化三铁与氢气,化学方程式为:3Fe+4 H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2↑,故答案为:3Fe+4 H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2↑;
(3)U、V、W形成的10电子氢化物分别是CH4、NH3、H2O,非金属性C<N<O,故氢化物稳定性:H2O>NH3>CH4,NH3与H2O间能形成氢键,是氨气极易溶于水的主要原因,原电池负极发生氧化反应,氨气在负极失去电子,进行条件下生成氮气与水,负极电极反应式为:2NH3-6e-+6OH-=N2+6H2O,
故答案为:H2O>NH3>CH4;NH3与H2O间能形成氢键;2NH3-6e-+6OH-=N2+6H2O.
点评 本题考查元素化合物推断,需要学生熟练掌握元素化合物性质,关键是正确推断元素,需要学生具备扎实的基础,难度中等.

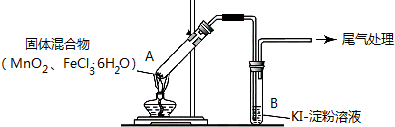
实验操作和现象:
| 操作 | 现象 |
| 点燃酒精灯,加热 | i.A中部分固体溶解,上方出现白雾 ii.稍后,产生黄色气体,管壁附着黄色液滴 iii.B中溶液变蓝 |
(2)分析现象 ii,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3•6H2O,产生白雾和黄色气体.
b.用KSCN 溶液分别检验现象 ii 和a 中的黄色气体,溶液均变红.
通过该实验说明现象 ii 中黄色气体含有FeCl3.
(3)除了氯气可使B中溶液变蓝外,推测还可能的原因是:
①实验b 检出的气体使之变蓝,反应的离子方程式是2Fe3++2I-=2Fe2++I2.实验证实推测成立.
②溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝.通过进一步实验确认了这种可能性,其实验方案是另取一支试管,向其中加入KI淀粉溶液,再滴入几滴 HCl溶液,在空气中放置,若一段时间后溶液变蓝则推测成立.
(4)为进一步确认黄色气体是否含有 Cl2,小组提出两种方案,均证实了Cl2的存在.
| 方案1 | 在A、B间增加盛有某种试剂的洗气瓶C | B中溶液变为蓝色 |
| 方案2 | 将B中KI淀粉溶液替换为NaBr溶液;检验 Fe2+ | B中溶液呈浅橙红色;未检出Fe2+ |
②方案2 中检验 Fe2+的原因是排除Fe3+将Br-氧化成Br2 的可能性.
(5)将A中产物分离得到Fe2O3和MnCl2,A中发生反应的化学方程式是3MnO2+4FeCl3•6H2O$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+3MnCl2+3Cl2↑+24H2O.
| A. | 常温下,用pH计测量0.1mol•L-1FeCl3溶液的pH为a,再测量稀释10倍的0.01mol•L-1FeCl3溶液的pH为b,可判断出FeCl3水解程度与盐溶液浓度大小关系 | |
| B. | 将装有3~4mL无水乙醇的试管浸入50℃左右的热水中,将烧黑的铜丝迅速插入无水乙醇中,可观察到铜丝变红,反复数次,可闻到刺激性气味 | |
| C. | 向某溶液加浓NaOH溶液并微热,若产生的气体能使湿润的红色石蕊试纸变蓝,则说明此溶质为铵盐 | |
| D. | 酸碱中和滴定到终点读数时,发现滴定管尖嘴处悬挂一滴标准溶液,导致实验结果偏高 |
| A. | 乙烯的结构简式为CH2CH2 | B. | 羟基的电子式: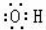 | ||
| C. | Ca2+的结构示意图为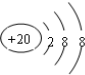 | D. | 乙醇的分子式:CH3CH2OH |
| A. | SO2可以漂白纸浆和草帽辫 | |
| B. | 单质硅可用做半导体材料 | |
| C. | 小苏打可作食品的膨松剂 | |
| D. | 合成纤维和光导纤维都是新型无机非金属材料 |
| A. | 常温下,0.5mo1•L-1Fe2(SO4)3溶液中含Fe3+数目为1NA | |
| B. | 标准状况下,22.4L苯中含C-H数目为6NA | |
| C. | 常温常压下,16gO2和O3混合气体中,含氧原子的总数为1NA | |
| D. | 5.6gFe与足量稀盐酸反应,转移电子数为0.3NA |
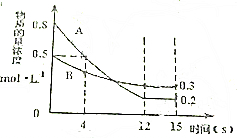 已知:反应aA(g)+bB(g)?cC(g)某温度下,在2L的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示.
已知:反应aA(g)+bB(g)?cC(g)某温度下,在2L的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示.