题目内容
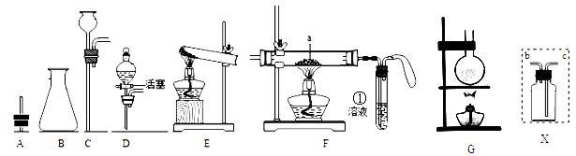
18.I2O5为白色固体,易吸水形成碘酸,I2O5与CO反应的化学方程式为I2O5+5CO═I2+5CO2,某化学课外话动小组设计实验用I2O5测定空气中CO的含量.可供选择的实验装置如图: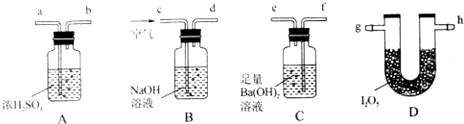
实验步骤如下:
①连接装置,检查气密性,装入药品;
②通入含CO的空气一段时间,观察现象;
③停止通入空气.测定C内沉淀质量.
回答下列问题:
(3)装置正确的连接顺序为cdabghfe(用导管接口字母表示).
(4)B中NaOH溶液的作用为吸收通入空气中的二氧化碳气体.
(5)D中的现象为D中固体部分变为紫黑色.
(6)实验中通入空气的速率为V0mL/min,测得在0-tmin内C装置中生成沉淀质量为mg,假设I2O5足量且与CO充分反应,此条件下的气体摩尔体积为VmL/mol,计算空气中CO的体积分数为$\frac{1000m{V}_{m}}{197{V}_{0}t}$×100%.某同学认为上述方法存在误差,他的理由可能为反应生成的二氧化碳没有完全被氢氧化钡溶液吸收.
分析 (3)I2O5为白色固体,易吸水,与CO反应的化学方程式为I2O5+5CO=I2+5CO2,用I2O5测定空气中CO的含量,需要依据此反应生成产物出现的现象和质量变化,计算一氧化碳的含量,所以空气先通过装置B中氢氧化钠溶液吸收空气中的二氧化碳,防止干扰测定含量,I2O5为白色固体,易吸水,所以再通过装置A中的浓硫酸干燥气体,通入装置D和)I2O5反应,生成的二氧化碳可以利用装置C吸收气体二氧化碳前后的质量变化计算;
(4)装置B中氢氧化钠是除去空气中的二氧化碳;
(5)分析可知,装置D中发生反应I2O5+5CO=I2+5CO2,生成紫黑色固体碘单质;
(6)测得在0-tmin内C装置中生成沉淀质量为mg为BaCO3,是一氧化碳和I2O5反应生成的二氧化碳,物质的量n(BaCO3)=n(CO2)=n(CO)=$\frac{mg}{197g/mol}$=$\frac{m}{197}$mol,空气的体积为V0mL/min×tmin=V0tml=V0t×10-3L,n(空气)=$\frac{{V}_{0}t×1{0}^{-3}L}{{V}_{m}L/mol}$=$\frac{{V}_{0}t×1{0}^{-3}}{{V}_{m}}$mol,计算得到空气中CO的体积分数,某同学认为上述方法存在误差的原因可能是生成的二氧化碳未被氢氧化钡溶液全部吸收.
解答 解:(3)I2O5为白色固体,易吸水,与CO反应的化学方程式为I2O5+5CO=I2+5CO2,用I2O5测定空气中CO的含量,需要依据此反应生成产物出现的现象和质量变化,计算一氧化碳的含量,所以空气先通过装置B中氢氧化钠溶液吸收空气中的二氧化碳,防止干扰测定含量,I2O5为白色固体,易吸水,所以再通过装置A中的浓硫酸干燥气体,通入装置D和)I2O5反应,生成的二氧化碳可以利用装置C吸收气体二氧化碳前后的质量变化计算,依据步骤可知装置连接顺序为:cdabghfe,
故答案为:cdabghfe;
(4)装置B中氢氧化钠是除去空气中的二氧化碳,
故答案为:吸收通入空气中的二氧化碳气体;
(5)分析可知,装置D中发生反应I2O5+5CO=I2+5CO2,生成紫黑色固体碘单质,
故答案为:D中固体部分变为紫黑色;
(6)测得在0-tmin内C装置中生成沉淀质量为mg为BaCO3,是一氧化碳和I2O5反应生成的二氧化碳,物质的量n(BaCO3)=n(CO2)=n(CO)=$\frac{mg}{197g/mol}$=$\frac{m}{197}$mol,空气的体积为V0mL/min×tmin=V0tml=V0t×10-3L,n(空气)=$\frac{{V}_{0}t×1{0}^{-3}L}{{V}_{m}L/mol}$=$\frac{{V}_{0}t×1{0}^{-3}}{{V}_{m}}$mol,
空气中CO的体积分数=$\frac{\frac{m}{197}mol}{\frac{{V}_{0}t×1{0}^{-3}}{{V}_{m}}}$×100%=$\frac{1000m{V}_{m}}{197{V}_{0}t}$×100%,某同学认为上述方法存在误差的原因可能是生成的二氧化碳未被氢氧化钡溶液全部吸收,
故答案为:$\frac{1000m{V}_{m}}{197{V}_{0}t}$×100%;反应生成的二氧化碳没有完全被氢氧化钡溶液吸收.
点评 本题考查了物质组成的实验探究方法和构成分析判断,主要是物质性质、实验装置连接和装置中试剂作用的分析应用,题目难度中等.

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案| A. | 若a=b且c(X-)=c(Y-)+c(HY),则HX为强酸 | |
| B. | 若a=b且pH(NaX)>pH(NaY),则c(X-)+c(OH-)>c(Y-)+c(OH-) | |
| C. | 若a>b且c(X-)=c(Y-),则酸性HX>HY | |
| D. | 若两溶液等体积混合,则c(Na+)=(a+b) mol/L(忽略混合过程中的体积变化) |
| A. | pH>7,且c(Na +)>c(OH -)>c(H +)>c(CH3COO-) | |
| B. | pH>7,且c(Na +)+c(H+)=c(CH3COO -)+c(OH-) | |
| C. | PH<7,且c(CH3COO -)>c(H+)>c(Na+)>c(OH-) | |
| D. | pH=7,且c(CH3COO -)=c(Na+)>c(H+)=c(OH-) |
| A. | NaCl | B. | S | C. | KOH | D. | H2S |
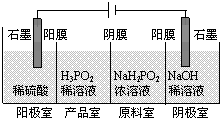 次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:

 .
.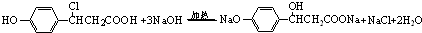 .
.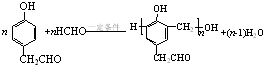 .
.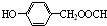 .
.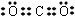 ;
;
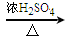 CO↑+H2O),用纯净的CO完成该实验。
CO↑+H2O),用纯净的CO完成该实验。