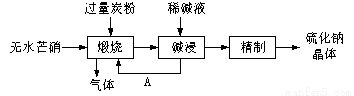
题目内容
19.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 常温下,0.5mo1•L-1Fe2(SO4)3溶液中含Fe3+数目为1NA | |
| B. | 标准状况下,22.4L苯中含C-H数目为6NA | |
| C. | 常温常压下,16gO2和O3混合气体中,含氧原子的总数为1NA | |
| D. | 5.6gFe与足量稀盐酸反应,转移电子数为0.3NA |
分析 A.缺少溶液体积,无法计算溶液中铁离子的数目;
B.标准状况下,苯的状态不是气态;
C.氧气和臭氧分子中都只含有氧元素,根据n=$\frac{m}{M}$计算出混合物中含有氧原子的物质的量;
D.铁与稀盐酸反应生成的是氯化亚铁.
解答 解:A.没有告诉0.5mo1•L-1Fe2(SO4)3溶液的体积,无法计算溶液中含有的铁离子数目,故A错误;
B.标准状况下苯不是气体,不能使用标准状况下的气体摩尔体积计算,故B错误;
C.16gO2和O3混合气体中含有16g氧元素,含有氧原子的物质的量为:$\frac{16g}{16g/mol}$=1mol,含氧原子的总数为NA,故C正确;
D.5.6g铁的物质的量为:$\frac{5.6g}{56g/mol}$=0.1mol,0.1molFe与足量稀盐酸反应生成0.1mol氯化亚铁,转移了0.2mol电子,转移电子数为0.2NA,故D错误;
故选C.
点评 本题考查了物质的量的计算与判断,题目难度中等,注意掌握物质的量与阿伏伽德罗常数、摩尔质量、气体摩尔体积的关系,明确标准状况下气体摩尔体积的使用条件,试题培养了学生的分析能力及化学计算能力.

 名校课堂系列答案
名校课堂系列答案| A. | NaCl | B. | S | C. | KOH | D. | H2S |
| A. | 正极质量不变 | B. | 电流通过导线由铜片流向银片 | ||
| C. | 烧杯中Ag+浓度逐渐减小 | D. | 电池工作时,铜片失电子,被还原 |
现有三种可溶物质A、B、C,其中A、B是盐,一种是酸式盐,一种是正盐,C是碱,它们溶于水后电离产生的所用离子如下表所示:
阳离子 |
|
阴离子 |
|
请根据下列叙述回答问题:
(1)C的化学式为_________________。
(2)A溶液与B溶液反应可生成气体X,则X的化学式为_______________________, 该反应的离子方程式为___________________.
该反应的离子方程式为___________________.
(3)A、B溶液与C溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸.
①B的化学式为____________,鉴别溶液中B的阴离子的方法是____________________.
②D溶于稀硝酸的离子方程式为________________________.
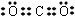 ;
; 、
、 、
、
 、
、 、
、
 2CH3COO-+Cu2++H2↑
2CH3COO-+Cu2++H2↑

 CO↑+H2O),用纯净的CO完成该实验。
CO↑+H2O),用纯净的CO完成该实验。