题目内容
18.下列叙述正确的是( )| A. | 浓硫酸具有吸水性,因而能使蔗糖炭化 | |
| B. | 浓硫酸在常温下不容易与铜片反应放出二氧化硫气体 | |
| C. | 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 | |
| D. | 浓硫酸在常温下能够使铁、铝、锌等金属钝化 |
分析 浓硫酸使蔗糖炭化,是利用了浓硫酸的脱水性;浓硫酸虽然具有氧化性,但和铜反应时需要加热;氨气是一种碱性气体,不能用浓硫酸来干燥,可以用碱石灰来干燥氨气.在浓硫酸中发生钝化的是铁和铝,据此分析.
解答 解:A.浓硫酸具有脱水性,可使蔗糖碳化,故A错误;
B.浓硫酸与铜的反应应在加热条件下进行,在常温下不容易反应,故B正确;
C.浓硫酸与氢气不反应,可用于干燥氢气,能与氨气反应所以不能用浓硫酸干燥,故C错误;
D.浓硫酸具有强氧化性,在常温下可使铁、铝等金属在表面生成一层致密的氧化膜而钝化,不能使Zn钝化,故D错误.
故选B.
点评 本题考查浓硫酸的性质,为高考高频考点,侧重于学生的基础知识的综合理解和运用的考查,注意把握浓硫酸的特性以及性质之间的区别,难度不大,注意相关基础的积累.

练习册系列答案
相关题目
8.已知0.1mol•L-1的醋酸溶液中存在电离平衡:CH3COOH???CH3COO-+H+,要使溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$值增大,可以采取的措施是( )
①加水 ②升高温度 ③加少量冰醋酸④加少量烧碱固体.
①加水 ②升高温度 ③加少量冰醋酸④加少量烧碱固体.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
13.化学工业是国民经济的支柱产业,下列生产过程中不涉及化学变化的是( )
| A. | 氮肥厂用氢气和氮气合成氨 | |
| B. | 钢铁在潮湿空气中生锈 | |
| C. | 往硫酸铜晶体上滴入浓硫酸,颜色由蓝色变成白色 | |
| D. | 石油分馏后得汽油、煤油等 |
3.要使Ba2+、Al3+、Cu2+、Mg2+、Ag+五种离子从混合液中逐一沉淀析出,下列选用的试剂和加入的顺序正确的是( )
| A. | HCl→H2SO4→H2S→NaOH→CO2 | B. | NaCl→Na2SO4→NaOH→H2S→CO2 | ||
| C. | Na2S→Na2SO4→NaCl→NaOH→CO2 | D. | Na2SO4→HCl→H2S→NaOH→CO2 |
10.有Al、CuO、Fe2O3组成的混合物共10.0g,放入250mL某浓度的盐酸中,混合物完全溶解,当再加入250mL 2.00mol•L-1的NaOH溶液时,得到沉淀最多.上述盐酸的浓度为( )
| A. | 1.00 mol•L-1 | B. | 0.500 mol•L-1 | C. | 2.00 mol•L-1 | D. | 3.00 mol•L-1 |

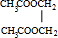 +2H2O.
+2H2O.