题目内容
3.要使Ba2+、Al3+、Cu2+、Mg2+、Ag+五种离子从混合液中逐一沉淀析出,下列选用的试剂和加入的顺序正确的是( )| A. | HCl→H2SO4→H2S→NaOH→CO2 | B. | NaCl→Na2SO4→NaOH→H2S→CO2 | ||
| C. | Na2S→Na2SO4→NaCl→NaOH→CO2 | D. | Na2SO4→HCl→H2S→NaOH→CO2 |
分析 将Ag+、Cu2+、Mg2+、Ba2+、Al3+五种离子逐一沉淀并分离,则每加入一种物质只能产生一种沉淀,所以加入顺序为NaCl(生成AgCl沉淀)、Na2SO4(生成BaSO4沉淀)、Na2S(生成CuS沉淀)、足量氢氧化钠(生成Mg(OH)2沉淀)、少量酸或CO2(生成Al(OH)3沉淀),以此解答该题.
解答 解:A.可依次生成AgCl、BaSO4、CuS、Mg(OH)2、Al(OH)3等沉淀,符合题目要求,故A正确;
B.先加入NaOH再加入H2S,可生成氢氧化铝、氢氧化铜和氢氧化镁沉淀,不能逐一生成沉淀,故B错误;
C.先加入硫化钠,可同时生成硫化银、硫化铜、氢氧化铝(水解生成)等沉淀,故C错误;
D.先加入硫酸钠,可生成硫酸银、硫酸钡沉淀,故D错误.
故选A.
点评 本题考查物质的分离、提纯,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,为高频考点,把握物质的性质为解答该题的关键,注意加NaOH足量生成一种沉淀及离子逐一形成沉淀析出,题目难度不大.

练习册系列答案
相关题目
13.用纯碱固体配制一定物质的量浓度的该溶液时,不需要使用的玻璃仪器是( )
| A. | 玻璃棒 | B. | 胶头滴管 | C. | 容量瓶 | D. | 圆底烧瓶 |
14.高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大.以下是某温度下这四种酸在冰醋酸中的电离常数:从表格中判断以下说明不正确的是( )
| 酸 | HClO4 | H2SO4 | HCl | HNO3 |
| Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
| A. | 在冰醋酸中,高氯酸的酸性最强 | |
| B. | 水对于这四种酸的强弱没有区分能力,但醋酸可以区分这四种酸的强弱 | |
| C. | 在冰醋酸中1mol/L的高氯酸的电离度约为0.4% | |
| D. | 在冰醋酸中硫酸的电离方程式为:H2SO4═2H++SO42- |
11.下列实验“操作和现象”与“结论”对应关系正确的是( )
| A. | 向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出,氧化性:Cu2+>Fe3+ | |
| B. | 用石墨作电极电解MgSO4溶液,某电极附近有白色沉淀生成该电极为阳极 | |
| C. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测结果偏低 | |
| D. | 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成 该溶液中一定含有Ag+ |
18.下列叙述正确的是( )
| A. | 浓硫酸具有吸水性,因而能使蔗糖炭化 | |
| B. | 浓硫酸在常温下不容易与铜片反应放出二氧化硫气体 | |
| C. | 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 | |
| D. | 浓硫酸在常温下能够使铁、铝、锌等金属钝化 |
8.下列叙述正确的是( )
| A. | 95℃纯水的pH<7,说明加热可导致水呈酸性 | |
| B. | pH=3的醋酸溶液,稀释至10倍后pH=4 | |
| C. | 0.2 mol•L-1的盐酸与等体积水混合后pH=1 | |
| D. | pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7 |
9.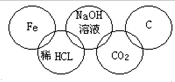 某同学在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连间不能发生反应.你认为在“五连环”物质的反应中,属于氧化还原反应的有几个,哪种基本反应类型没有涉及到( )
某同学在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连间不能发生反应.你认为在“五连环”物质的反应中,属于氧化还原反应的有几个,哪种基本反应类型没有涉及到( )
 某同学在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连间不能发生反应.你认为在“五连环”物质的反应中,属于氧化还原反应的有几个,哪种基本反应类型没有涉及到( )
某同学在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连间不能发生反应.你认为在“五连环”物质的反应中,属于氧化还原反应的有几个,哪种基本反应类型没有涉及到( )| A. | 1个、复分解反应 | B. | 2个、分解反应 | C. | 3个、化合反应 | D. | 2个、置换反应 |