题目内容
18.下列试剂不会因为空气中的氧气而变质的是( )| A. | 亚硫酸钠 | B. | 过氧化钠 | C. | 硫酸亚铁 | D. | 氢硫酸 |
分析 一般来说,具有还原性的物质防止在空气中被氧化而变质,根据元素的化合价判断,以此解答.
解答 解:A.亚硫酸钠和氧气反应生成硫酸钠,会因空气中的氧气而变质,故A不选;
B.过氧化钠和空气中二氧化碳、水蒸气反应,但和氧气不反应,不会因空气中的氧气而变质,故B选;
C.硫酸亚铁和氧气反应生成硫酸铁,会因空气中的氧气而变质,故C不选;
D.氢硫酸和氧气反应生成硫和水,会因空气中的氧气而变质,故D不选.
故选B.
点评 本题考查了氧化还原反应,涉及一些常见物质在空气中发生反应的问题,是对学生进行物质性质的训练与提高,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.下列说法正确的是( )
| A. | 氯碱工业中NaOH的溶液在阳极区产生 | |
| B. | 电解精炼铜时,阳极质量的减小等于阴极质量的增加 | |
| C. | 铁制品表面镀镍时,镀件做阳极 | |
| D. | 电解法制铝的过程中需不断补充阳极材料(石墨电极) |
9.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使pH试纸显深蓝色的溶液中:NH4+、NO3-、SO42-、Na+ | |
| B. | 由水电离的c(H+)=1×10-14mol•L-1的溶液中:Ca2+、K+、HCO3-、NO3- | |
| C. | pH=1的无色溶液中:K+、Fe3+、SO42-、SCN- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:Mg2+、Al3+、NO3-、Cl- |
6.在一定温度下,下列叙述说明可逆反应A(g)+2B(g)?2C(g) 达到平衡的是( )
| A. | A、B、C的浓度之比为1:2:2 | |
| B. | 单位时间内消耗a molA,同时生成2a mol C | |
| C. | A的浓度不再变化 | |
| D. | 混合气体总物质的量为2a mol |
13.用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸反应的产物,下列有关说法正确的是( )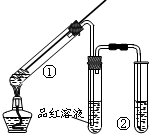

| A. | 品红溶液的作用是吸收SO2,防止污染空气 | |
| B. | 试管②中盛放的试剂通常是NaOH溶液 | |
| C. | 试管①中有白色固体生成,向①中加水后溶液呈蓝色 | |
| D. | 该反应中浓硫酸既表现了强氧化性,又表现了酸性 |
3.下列鉴别方法正确的是( )
| A. | 用澄清石灰水鉴别CO2和SO2 | |
| B. | 用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2 | |
| C. | 用CO2鉴别Na[Al(OH)4]溶液和NaClO溶液 | |
| D. | 用Ba(OH)2溶液鉴别Na2CO3溶液和NaHCO3溶液 |
18.某同学按下述操作配制100 mL 0.20 mol•L-1Na2SO4溶液,请回答有关问题.
(2)取出该Na2SO4溶液10mL加水稀释到100mL,稀释后溶液中Na+的物质的量浓度是0.04mol/L.
(3)在实验中,以下操作对实验结果没有影响的是C.
A.没有将洗涤液转移到容量瓶中 B.定容时仰视刻度线
C.转移前没有将使用的容量瓶烘干
D.定容摇匀后,发现凹液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
(4)请写出检验溶液中的SO42-的具体操作:取少量待测液,滴加稀盐酸,若无明显现象,再滴加氯化钡溶液,产生白色沉淀.
| (1)实验步骤 | 有关问题 |
| ①计算所需Na2SO4的质量 | 需要称量Na2SO4的质量为3.0g |
| ②称量Na2SO4固体 | 称量需要用到的主要仪器是:托盘天平 |
| ③将Na2SO4加入100mL烧杯中,并加入适量水 | 用玻璃棒搅拌至完全溶解,冷却至室温 |
| ④将烧杯中溶液转移至仪器A中(已检查不漏水) | 仪器A是100mL容量瓶; |
| ⑤洗涤烧杯,转移,定容 | \ |
| ⑥摇匀、装瓶、贴上标签 | \ |
(3)在实验中,以下操作对实验结果没有影响的是C.
A.没有将洗涤液转移到容量瓶中 B.定容时仰视刻度线
C.转移前没有将使用的容量瓶烘干
D.定容摇匀后,发现凹液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
(4)请写出检验溶液中的SO42-的具体操作:取少量待测液,滴加稀盐酸,若无明显现象,再滴加氯化钡溶液,产生白色沉淀.