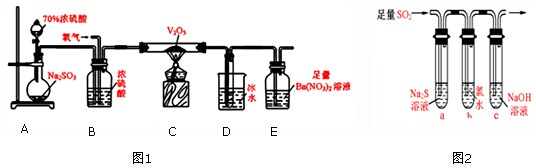
题目内容
某兴趣小组通过如图2装置探究SO2的性质,根据实验装置图.请回答:
(1)写出生成SO2的化学方程式: .
(2)证明SO2有漂白性的现象为 ,写出SO2气体通入FeCl3溶液中发生反应的离子方程式: .
(3)能表明I-的还原性弱于SO2的现象是 .
(4)待通入足量的SO2充分反应后,为了验证SO2与Fe3+发生了氧化还原反应,取少量反应后溶液分成两份,并设计了如下实验:
方案①:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红上述方案不合理的是 ,原因是 .
(5)请在答题卷中画出尾气吸收装置如图1,并指明烧杯中所用试剂.

(1)写出生成SO2的化学方程式:
(2)证明SO2有漂白性的现象为
(3)能表明I-的还原性弱于SO2的现象是
(4)待通入足量的SO2充分反应后,为了验证SO2与Fe3+发生了氧化还原反应,取少量反应后溶液分成两份,并设计了如下实验:
方案①:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红上述方案不合理的是
(5)请在答题卷中画出尾气吸收装置如图1,并指明烧杯中所用试剂.
考点:探究二氧化硫与水和品红溶液的反应
专题:实验设计题
分析:(1)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫气体和水,据此写出反应的化学方程式;
(2)试管中品红溶液褪色证明了二氧化硫具有漂白性;铁离子与二氧化硫发生氧化还原反应生成亚铁离子和硫酸根离子,据此写出反应的离子方程式;
(3)二氧化硫能使含有碘的淀粉溶液褪色,说明发生了氧化还原反应,根据还原剂的还原性大于还原产物的还原性分析;
(4)二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,Fe2+也使高锰酸钾溶液褪色;
(5)二氧化硫有毒,需要使用尾气吸收装置,根据二氧化硫的化学性质选择吸收试剂,然后画出装置图.
(2)试管中品红溶液褪色证明了二氧化硫具有漂白性;铁离子与二氧化硫发生氧化还原反应生成亚铁离子和硫酸根离子,据此写出反应的离子方程式;
(3)二氧化硫能使含有碘的淀粉溶液褪色,说明发生了氧化还原反应,根据还原剂的还原性大于还原产物的还原性分析;
(4)二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,Fe2+也使高锰酸钾溶液褪色;
(5)二氧化硫有毒,需要使用尾气吸收装置,根据二氧化硫的化学性质选择吸收试剂,然后画出装置图.
解答:
解:(1)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水,反应的方程式为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;
(2)二氧化硫具有漂白性,能够使品红溶液褪色;
SO2做还原剂,被氧化为硫酸根离子,Fe3+作氧化剂,被还原为Fe2+,离子方程式为:SO2+2Fe3++2H2O═2Fe2++SO42-+4H+,
故答案为:品红溶液褪色;SO2+2Fe3++2H2O═2Fe2++SO42-+4H+;
(3)二氧化硫能使含有碘的淀粉溶液褪色,说明发生了氧化还原反应:I2+SO2+2H2O=2HI+H2SO4,碘是氧化剂,二氧化硫是还原剂,还原剂的还原性大于还原产物的还原性,
故答案为:装置B中溶液蓝色褪去;
(4)二氧化硫有还原性,高锰酸钾有强氧化性,二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,Fe2+也使高锰酸钾溶液褪色,
故答案为:方案①;过量的SO2也能使KMnO4溶液褪色;
(5)二氧化硫有毒,需要用氢氧化钠溶液稀释多余的气体,则画出的尾气吸收装置为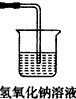 ,故答案为:
,故答案为: .
.
| ||
故答案为:Cu+2H2SO4(浓)
| ||
(2)二氧化硫具有漂白性,能够使品红溶液褪色;
SO2做还原剂,被氧化为硫酸根离子,Fe3+作氧化剂,被还原为Fe2+,离子方程式为:SO2+2Fe3++2H2O═2Fe2++SO42-+4H+,
故答案为:品红溶液褪色;SO2+2Fe3++2H2O═2Fe2++SO42-+4H+;
(3)二氧化硫能使含有碘的淀粉溶液褪色,说明发生了氧化还原反应:I2+SO2+2H2O=2HI+H2SO4,碘是氧化剂,二氧化硫是还原剂,还原剂的还原性大于还原产物的还原性,
故答案为:装置B中溶液蓝色褪去;
(4)二氧化硫有还原性,高锰酸钾有强氧化性,二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,Fe2+也使高锰酸钾溶液褪色,
故答案为:方案①;过量的SO2也能使KMnO4溶液褪色;
(5)二氧化硫有毒,需要用氢氧化钠溶液稀释多余的气体,则画出的尾气吸收装置为
 ,故答案为:
,故答案为: .
.
点评:本题考查的是二氧化硫的性质及实验室制法,题目难度中等,注意掌握二氧化硫的性质及检验方法,明确二氧化硫的漂白性与氯水漂白性的区别,试题有利于提高学生的分析、理解能力.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
化学反应的实质就是旧键的断裂和新键的形成.欲探讨发生化学反应时分子中化学键在何处断裂的问题,近代科技常用同位素示踪原子法.如有下列反应:2R-14CH═CH-R′
R-14CH═CH-R+R′-14CH═CH-R′
可以推知,物质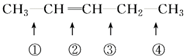 发生此反应时断裂的化学键应是( )
发生此反应时断裂的化学键应是( )
| 一定条件 |
可以推知,物质
 发生此反应时断裂的化学键应是( )
发生此反应时断裂的化学键应是( )| A、①④ | B、①③ | C、② | D、②③ |
将气体CO2通过MgCl2溶液中,若要有白色沉淀产生,可加入的试剂是( )
| A、KHSO4溶液 |
| B、CaCl2 |
| C、氯气 |
| D、NaOH溶液 |
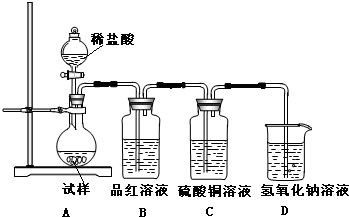 化学是一门以实验为基础的科学,大家都从实验中学化学,为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和图所示的实验装置进行实验.请回答下列有关问题:
化学是一门以实验为基础的科学,大家都从实验中学化学,为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和图所示的实验装置进行实验.请回答下列有关问题: