题目内容
工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如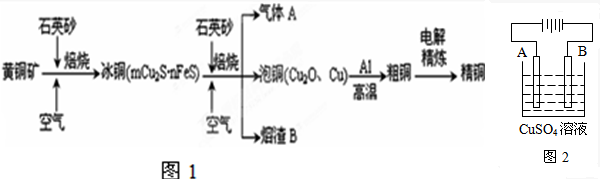
(1)气体A中的大气污染物可选用下列试剂中的 吸收.
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)①冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%.转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼.冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式是 ;
②熔渣B的主要成分是 .
(3)由泡铜冶炼粗铜的化学反应方程式为 .
(4)粗铜(含Fe、Ag、Pt、Au等杂质)的电解精炼如图2,A极上发生的反应为 ,下列说法正确的是 .
a.电能全部转化为化学能 b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动 d.阴阳两极质量变化相等
(5)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极的电极反应式为 .

(1)气体A中的大气污染物可选用下列试剂中的
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)①冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%.转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼.冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式是
②熔渣B的主要成分是
(3)由泡铜冶炼粗铜的化学反应方程式为
(4)粗铜(含Fe、Ag、Pt、Au等杂质)的电解精炼如图2,A极上发生的反应为
a.电能全部转化为化学能 b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动 d.阴阳两极质量变化相等
(5)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极的电极反应式为
考点:铜金属及其重要化合物的主要性质
专题:几种重要的金属及其化合物
分析:(1)由流程图转化可知,气体A中的大气污染物主要是二氧化硫,选择试剂吸收二氧化硫,不能产生新的污染气体,二氧化硫是酸性氧化物,结合选项中各物质的性质判断;
(3)由流程图转化可知,Cu2O与Al反应置换反应生成Al2O3与Cu;
(4)由A极为阳极,故铁先放电,铜后放电,依据电极方程式的书写规则写出即可;
a、反应中有热能产生;
b、精炼铜时,粗铜做阳极;
c、溶液中Cu2+向阴极移动;
d、粗铜中铁比铜活泼,故先放电,故两极质量变化不等;
(5)利用原电池原理,负极失电子发生氧化反应,正极上得到电子发生还原反应.
(3)由流程图转化可知,Cu2O与Al反应置换反应生成Al2O3与Cu;
(4)由A极为阳极,故铁先放电,铜后放电,依据电极方程式的书写规则写出即可;
a、反应中有热能产生;
b、精炼铜时,粗铜做阳极;
c、溶液中Cu2+向阴极移动;
d、粗铜中铁比铜活泼,故先放电,故两极质量变化不等;
(5)利用原电池原理,负极失电子发生氧化反应,正极上得到电子发生还原反应.
解答:
解:(1)由流程图转化可知,气体A中的大气污染物主要是二氧化硫,选择试剂吸收二氧化硫,不能产生新的污染气体,
a、浓H2SO4不能吸收二氧化硫,故a错误;
b、稀HNO3可以吸收二氧化硫,但生成NO污染大气,故b错误;
c、NaOH溶液与二氧化硫反应生成亚硫酸钠,故c正确;
d、氨水与二氧化硫反应生成亚硫酸铵,故d正确;
(2)①Cu2S被氧化为Cu2O的反应方程式为:2Cu2S+3O2
2Cu2O+2SO2;Cu2O与Cu2S发生反应的方程式为:2Cu2O+Cu2S
6Cu+2SO2↑;②反射炉内生成炉渣的主要成分是FeSiO3;故答案为:①2Cu2S+3O2
2Cu2O+2SO2;2Cu2O+Cu2S
6Cu+2SO2↑;②FeSiO3;
(3)由流程图转化可知,Cu2O与Al反应置换反应生成Al2O3与Cu,反应方程式为3Cu2O+2Al
Al2O3+6Cu,
故答案为:3Cu2O+2Al
Al2O3+6Cu;
(4)A极反应为:Fe-2e-=Fe2+,Cu-2e-=Cu2+;
a、反应中有热能产生,故a错误;
b、精炼铜时,粗铜做阳极,连接电源正极,发生氧化反应,故b正确;
c、溶液中Cu2+向阴极移动,故c错误;
d、铁先于铜放电,阴阳两极质量变化不等,故d错误;
故选b;
(5)利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,正极上是氧气得到电子发生还原反应,酸性溶液中生成的氢氧根离子以水的形式存在,其正极电极反应式为:4H++O2+4e-=2H2O,
故答案为:4H++O2+4e-=2H2O.
a、浓H2SO4不能吸收二氧化硫,故a错误;
b、稀HNO3可以吸收二氧化硫,但生成NO污染大气,故b错误;
c、NaOH溶液与二氧化硫反应生成亚硫酸钠,故c正确;
d、氨水与二氧化硫反应生成亚硫酸铵,故d正确;
(2)①Cu2S被氧化为Cu2O的反应方程式为:2Cu2S+3O2
| ||
| ||
| ||
| ||
(3)由流程图转化可知,Cu2O与Al反应置换反应生成Al2O3与Cu,反应方程式为3Cu2O+2Al
| ||
故答案为:3Cu2O+2Al
| ||
(4)A极反应为:Fe-2e-=Fe2+,Cu-2e-=Cu2+;
a、反应中有热能产生,故a错误;
b、精炼铜时,粗铜做阳极,连接电源正极,发生氧化反应,故b正确;
c、溶液中Cu2+向阴极移动,故c错误;
d、铁先于铜放电,阴阳两极质量变化不等,故d错误;
故选b;
(5)利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,正极上是氧气得到电子发生还原反应,酸性溶液中生成的氢氧根离子以水的形式存在,其正极电极反应式为:4H++O2+4e-=2H2O,
故答案为:4H++O2+4e-=2H2O.
点评:本题考查了元素化合物的性质、电化学知识、离子检验等知识点,难度较大,注意离子的检验是高考的热点,选取的试剂和检验离子反应后要有特殊现象,会运用知识迁移方法解决问题.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是( )
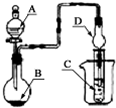

| A、若A为浓硫酸,B为铜,C中盛石蕊试液,则C中溶液先变红后褪色 |
| B、若A为醋酸,B为贝壳,C中盛CaCl2溶液,则C中溶液变浑浊 |
| C、若A为浓盐酸,B为二氧化锰,C中盛KI-淀粉溶液,则C中溶液变蓝 |
| D、若A为水,B为CaC2固体,C中盛溴水,则C中溶液褪色 |
某元素原子的质量数为52,中子数为28,其基态原子未成对电子数为( )
| A、1 | B、3 | C、4 | D、6 |
下列各项中的两种物质不论以何种比例混合,只要混合物的总物质的量一定,则完全燃烧消耗O2的质量保持不变的是( )
| A、C3H8、C4H6O2 |
| B、C2H6、C2H6O |
| C、C2H2、C6H6 |
| D、C3H6O、C3H8O2 |
 ),注:部分物质省略.
),注:部分物质省略.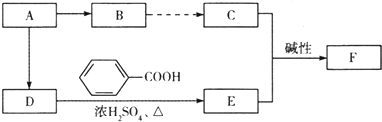

 原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,D原子外围电子排布为3d104s1.
原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,D原子外围电子排布为3d104s1.