题目内容
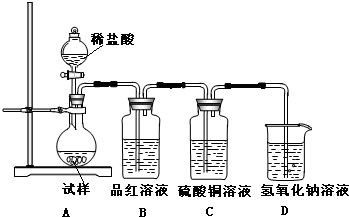 化学是一门以实验为基础的科学,大家都从实验中学化学,为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和图所示的实验装置进行实验.请回答下列有关问题:
化学是一门以实验为基础的科学,大家都从实验中学化学,为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和图所示的实验装置进行实验.请回答下列有关问题:(1)查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开始分解,且分解产物只有硫化钠和另外一种固体.猜想该固体的化学式为
(2)如果加热温度低于600℃,向所得固体试样中缓缓滴加稀盐酸至足量,在滴加稀盐酸的整个过程中HSO3-的物质的量浓度变化趋势为
(3)如果加热温度为700℃,向所得固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则反应生成淡黄色沉淀的离子方程式为
(4)利用钠碱循环法可消除硫酸厂烟气的SO2
①在钠碱循环法中,Na2SO3溶液作为吸收液,有关反应的离子方程式为
②在吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表所示:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
考点:探究二氧化硫与水和品红溶液的反应
专题:实验设计题
分析:(1)根据S元素的化合价的变化分析;
(2)由题意,Na2SO3要加热到600度以上才分解,因此题中加热温度600度以下冷却后得到的固体仍为Na2SO3;
(3)加热温度为700℃,向所得固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,说明加热分解后的固体中含硫化钠和为分解的亚硫酸钠;
(4)①Na2SO3溶液吸收二氧化硫生成亚硫酸氢钠;
②根据溶液中HSO3-浓度和SO32-浓度的相对大小确定溶液的酸碱性;
(2)由题意,Na2SO3要加热到600度以上才分解,因此题中加热温度600度以下冷却后得到的固体仍为Na2SO3;
(3)加热温度为700℃,向所得固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,说明加热分解后的固体中含硫化钠和为分解的亚硫酸钠;
(4)①Na2SO3溶液吸收二氧化硫生成亚硫酸氢钠;
②根据溶液中HSO3-浓度和SO32-浓度的相对大小确定溶液的酸碱性;
解答:
解:(1)无水亚硫酸钠隔绝空气受热到600℃才开始分解,且分解产物只有硫化钠和另外一种固体,Na2SO3中S为+4价,生成的Na2S中S为-2价,则另一种化合物中S的化合价要升高,则只能为+6价,所以另外一种固体为Na2SO4;
故答案为:Na2SO4;
(2)由题意,Na2SO3要加热到600度以上才分解,因此题中加热温度600度以下冷却后得到的固体仍为Na2SO3向此固体中滴加HCl后,一方面是Na2SO3固体溶于水,这将导致溶液中SO32-浓度增大;另一方面是HCl与SO32-反应,这将导致SO32-浓度减小生成亚硫酸氢根离子浓度增大;加入HCl到一定程度时,SO32-已完全转化为HSO3-,此时前者作用消失,完全是后者起作用,HSO3-浓度先增大后将逐渐减小,直至最后下降到接近于零,
故答案为:先逐渐增大,后逐渐减小;
(3)如果加热温度为700℃,向所得固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀为硫,且有大量气泡产生说明为二氧化硫,则固体试样跟盐酸反应生成淡黄色沉淀的离子方程式为:2S2-+SO32-+6H+=3S↓+3H2O;
故答案为:2S2-+SO32-+6H+=3S↓+3H2O;
(4)①Na2SO3溶液吸收二氧化硫生成亚硫酸氢钠,其反应的离子方程式为:SO2+SO32-+H2O=2HSO3-;
故答案为:SO2+SO32-+H2O=2HSO3-;
②在溶液中主要以HSO3-存在,HSO3-的电离很微弱,所以n(SO32-):n(HSO3-)<1:1,根据表格知,当亚硫酸氢根离子的物质的量大于亚硫酸根离子的物质的量时,亚硫酸氢钠溶液呈酸性;亚硫酸氢钠溶液中存在HSO3- SO32-+H+和HSO3-+H2O
SO32-+H+和HSO3-+H2O  H2SO3+OH-,HSO3-的电离程度大于水解程度,所以亚硫酸根离子的物质的量大于亚硫酸氢根;
H2SO3+OH-,HSO3-的电离程度大于水解程度,所以亚硫酸根离子的物质的量大于亚硫酸氢根;
故答案为:酸;HSO3-存在:HSO3- SO32-+H+和HSO3-+H2O
SO32-+H+和HSO3-+H2O  H2SO3+OH-,HSO3-的电离程度大于水解程度.
H2SO3+OH-,HSO3-的电离程度大于水解程度.
故答案为:Na2SO4;
(2)由题意,Na2SO3要加热到600度以上才分解,因此题中加热温度600度以下冷却后得到的固体仍为Na2SO3向此固体中滴加HCl后,一方面是Na2SO3固体溶于水,这将导致溶液中SO32-浓度增大;另一方面是HCl与SO32-反应,这将导致SO32-浓度减小生成亚硫酸氢根离子浓度增大;加入HCl到一定程度时,SO32-已完全转化为HSO3-,此时前者作用消失,完全是后者起作用,HSO3-浓度先增大后将逐渐减小,直至最后下降到接近于零,
故答案为:先逐渐增大,后逐渐减小;
(3)如果加热温度为700℃,向所得固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀为硫,且有大量气泡产生说明为二氧化硫,则固体试样跟盐酸反应生成淡黄色沉淀的离子方程式为:2S2-+SO32-+6H+=3S↓+3H2O;
故答案为:2S2-+SO32-+6H+=3S↓+3H2O;
(4)①Na2SO3溶液吸收二氧化硫生成亚硫酸氢钠,其反应的离子方程式为:SO2+SO32-+H2O=2HSO3-;
故答案为:SO2+SO32-+H2O=2HSO3-;
②在溶液中主要以HSO3-存在,HSO3-的电离很微弱,所以n(SO32-):n(HSO3-)<1:1,根据表格知,当亚硫酸氢根离子的物质的量大于亚硫酸根离子的物质的量时,亚硫酸氢钠溶液呈酸性;亚硫酸氢钠溶液中存在HSO3-
 SO32-+H+和HSO3-+H2O
SO32-+H+和HSO3-+H2O  H2SO3+OH-,HSO3-的电离程度大于水解程度,所以亚硫酸根离子的物质的量大于亚硫酸氢根;
H2SO3+OH-,HSO3-的电离程度大于水解程度,所以亚硫酸根离子的物质的量大于亚硫酸氢根;故答案为:酸;HSO3-存在:HSO3-
 SO32-+H+和HSO3-+H2O
SO32-+H+和HSO3-+H2O  H2SO3+OH-,HSO3-的电离程度大于水解程度.
H2SO3+OH-,HSO3-的电离程度大于水解程度.
点评:本题考查了物质性质验证的实验设计和实验分析判断,主要考查硫及其化合物性质的应用、离子方程式、化学方程式的书写、弱电解质的电离和盐的水解等,题目难度中等,侧重于基础知识的综合应用的考查.

练习册系列答案
相关题目
下列离子方程式书写不正确的是( )
| A、用醋酸溶解碳酸钙:2CH3COOH+CaCO3=2CH3COO-+Ca2++CO2↑+H2O |
| B、用硫酸酸化的桔红色的重铬酸钾(K2Cr2O7)溶液与乙醇作用生成乙酸和草绿色三价铬,可用于检测是否酒后驾驶:2Cr2O72-+3C2H5OH+16H+→4Cr3++3CH3COOH+11H2O |
| C、用氯酸钠的酸性溶液与H2O2作用制取ClO2:2ClO3-+H2O2+2H+=2ClO2↑+O2↑+2H2O |
| D、碳酸氢铵溶液中加入足量热的氢氧化钠溶液:NH4++OH-=NH3↑+H2O |
如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是( )
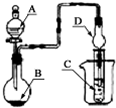

| A、若A为浓硫酸,B为铜,C中盛石蕊试液,则C中溶液先变红后褪色 |
| B、若A为醋酸,B为贝壳,C中盛CaCl2溶液,则C中溶液变浑浊 |
| C、若A为浓盐酸,B为二氧化锰,C中盛KI-淀粉溶液,则C中溶液变蓝 |
| D、若A为水,B为CaC2固体,C中盛溴水,则C中溶液褪色 |
下列各组溶液中,只用括号内的试剂及物质间相互反应无法鉴别的一组是( )
| A、Ba(OH)2、KSCN、NaCl、K2SO4(FeCl3溶液) |
| B、NaNO3、NaHCO3、Na2SO3、Na2SiO3(H2SO4溶液) |
| C、NaBr、Na2CO3、KI、CaCl2(AgNO3溶液) |
| D、NH4Cl、Mg(NO3)2、CuSO4、AlCl3(KOH溶液) |
下列各项中的两种物质不论以何种比例混合,只要混合物的总物质的量一定,则完全燃烧消耗O2的质量保持不变的是( )
| A、C3H8、C4H6O2 |
| B、C2H6、C2H6O |
| C、C2H2、C6H6 |
| D、C3H6O、C3H8O2 |
 下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃).
下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃).

 ),注:部分物质省略.
),注:部分物质省略.
