��Ŀ����
5����ѧ�г���ͼ��ֱ�۵�������ѧ��Ӧ�Ľ��̻���������ͼ��������ȷ���ǣ�������| A�� | 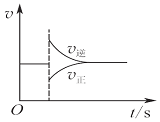 ͼ���Ա�ʾ��ij��ѧƽ����ϵ�ı��¶Ⱥ�Ӧ������ʱ��ı仯 | |
| B�� |  ͼ��ʾѹǿ�Կ��淴Ӧ2A��g��+2B��g��?3C��g��+D��g����Ӱ�죬�Ҽ�ѹǿ�� | |
| C�� |  ͼ��ʾ��Al2��SO4��3��MgSO4�Ļ��Һ�еμ�NaOH��Һ�����ɳ������������NaOH��Һ����Ĺ�ϵ | |
| D�� | 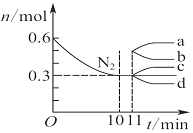 ͼ��ʾ��2 L���ܱ������з����ϳɰ���ӦʱN2�����ʵ�����ʱ��ı仯���ߣ�0��10 min�ڸ÷�Ӧ��ƽ������v��H2��=0.045 mol•L-1•min-1����11 min�������������䣬ѹ�����������Ϊ1 L����n��N2���ı仯����Ϊd |
���� A���ı䷴Ӧ�¶ȣ����淴Ӧ����ͬʱ������С��
B������ѹǿ��ƽ�ⲻ�ƶ�������Ӧ��������
C���������ƹ���ʱ��������þ���ܽ⣻
D����ѹǿ��ƽ���ƶ���Ӱ��ĽǶȷ�����
��� �⣺A���ı䷴Ӧ�¶ȣ����淴Ӧ����ͬʱ������С�������ܳ�����ͼ��ʾ�仯����A����
B������ѹǿ��ƽ�ⲻ�ƶ�������Ӧ�������ﵽƽ��ʱ����٣���B����
C���������ƹ���ʱ��������þ���ܽ⣬��Ӧ�����������Ϊ0����C����
D���������ʾ�������ʵ�����ѹ�����������˲�䣬�������ʵ������䣬�����С��Ч������ѹǿ��ƽ�������ƶ����������ʵ�����С����D��ȷ��
��ѡD��
���� ����Ϊͼ���⣬Ϊ�߿��������ͣ�������ѧ���ķ��������Ŀ��飬����ʱע�����ͼ���������ߵı仯�ص������������͵Ĺؼ��������Ѷ��еȣ�

��ϰ��ϵ�д�
�����Ŀ
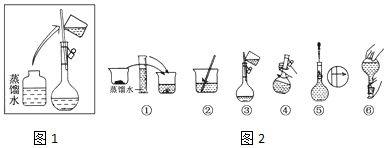
13�� ���к͵ζ����ⶨij��������ʵ���Ũ�ȣ�
���к͵ζ����ⶨij��������ʵ���Ũ�ȣ�
��1������ҺӦʢ��A���A����B�����ζ����У�
��2����ѡ�÷�̪��ָʾ������0.125 0mol•L-1�ı�����������Һ�ζ�������жϵζ��յ㵱�������һ�α�Һʱ����Һǡ�ó��ֺ�ɫ�Ұ�����ں�ɫ����ȥ
��3��ʵ�����ݼ�¼�������������ݲ����㣬��������ʵ���Ũ��=0.1250mol•L-1
 ���к͵ζ����ⶨij��������ʵ���Ũ�ȣ�
���к͵ζ����ⶨij��������ʵ���Ũ�ȣ���1������ҺӦʢ��A���A����B�����ζ����У�
��2����ѡ�÷�̪��ָʾ������0.125 0mol•L-1�ı�����������Һ�ζ�������жϵζ��յ㵱�������һ�α�Һʱ����Һǡ�ó��ֺ�ɫ�Ұ�����ں�ɫ����ȥ
��3��ʵ�����ݼ�¼�������������ݲ����㣬��������ʵ���Ũ��=0.1250mol•L-1
| �ζ����� | ����Һ�����/mL | ����Һ | |
| �ζ�ǰ����/mL | �ζ������/mL | ||
| �� | 20.0 | 0.40 | 20.41 |
| �� | 20.0 | 0.10 | 20.60 |
| �� | 20.0 | 4.00 | 23.99 |
14����NAΪ�����ӵ�����������˵������ȷ���ǣ�������
| A�� | NA������������ռ�����Ϊ22.4L | B�� | 2NA��������̼���ӵ�����Ϊ44g | ||
| C�� | 32g O2��������ԭ����Ŀ��2NA | D�� | 17g����������ԭ����ΪNA |
1�� �״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������ҵ��һ��������з�Ӧ�ϳɼ״�CO��g��+2H2��g��?CH3OH��g����H
�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������ҵ��һ��������з�Ӧ�ϳɼ״�CO��g��+2H2��g��?CH3OH��g����H
��1���±����������Ƿ�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
�ɱ��������жϡ�H��0�����������=������������ѧƽ�ⳣ������ʽK=$\frac{c��C{H}_{3}OH��}{c��CO��{c}^{2}��{H}_{2}��}$��
��2��300��ʱ�������Ϊ2.0L���ܱ�������ͨ��2mol CO��4mol H2������20s �ﵽƽ��״̬��
�ټ���20s��CO�ķ�Ӧ����Ϊ0.025mol/��L•s������ʱ�����м״����������Ϊ25%��
����������ƽ����ϵ��ͬʱ����1mol CO��2mol H2��1mol CH3OH���壬ƽ���ƶ����������
������ҡ����������ƶ�������ԭ������������ƽ����ϵ��ͬʱ����1molCO��2molH2��1molCH3OH���壬��ʱŨ��c��CO��=0.5mol/L+$\frac{1}{2}$mol/L=1mol/L��n��H2��=2��1-0.5��mol/L+$\frac{2mol}{2L}$=2mol/L��c��CH3OH��=0.5mol/L+$\frac{1mol}{2L}$=1mol/L����ʱŨ���Ϻ�Qc=$\frac{1}{1��{2}^{2}}$=0.25��K=1��ƽ�������ƶ���
��3����֪�ڳ��³�ѹ�£�
��2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��g����H1=-1277.0kJ/mol
��2CO��g��+O2��g��=2CO2��g����H2=-566.0kJ/mol
��H2O��g��=H2O��l����H3=-44kJ/molд���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��CH3OH��l��+O2��g��=CO��g��+2H2O��l����H=-443.5KJ/mol��
��4���״�������������ȼ�ϵ�أ�д������������Ϊ����ʼ״�ȼ�ϵ�ظ�����ӦʽCH3OH+8OH--6e-=CO32-+6H2O����ͼ�����KI��Һ�Ƶ⣬�ڴ��Թ��м��뱥�͵�KI��Һ��Ȼ���ټ��뱽������һ��ʯī�缫��һ�����缫��ʹ�ø�ȼ�ϵ������Դ�����缫�븺���������������ӣ�ͨ��һ��ʱ��Ͽ���Դ�����Թܣ��ϲ���ҺΪ�Ϻ�ɫ������1.27g �ⵥ������ʱ����Ҫ0.053g CH3OH��
 �״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������ҵ��һ��������з�Ӧ�ϳɼ״�CO��g��+2H2��g��?CH3OH��g����H
�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������ҵ��һ��������з�Ӧ�ϳɼ״�CO��g��+2H2��g��?CH3OH��g����H��1���±����������Ƿ�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
| �¶� | 250�� | 300�� | 350�� |
| K | 3.041 | 1.000 | 0.120 |
��2��300��ʱ�������Ϊ2.0L���ܱ�������ͨ��2mol CO��4mol H2������20s �ﵽƽ��״̬��
�ټ���20s��CO�ķ�Ӧ����Ϊ0.025mol/��L•s������ʱ�����м״����������Ϊ25%��
����������ƽ����ϵ��ͬʱ����1mol CO��2mol H2��1mol CH3OH���壬ƽ���ƶ����������
������ҡ����������ƶ�������ԭ������������ƽ����ϵ��ͬʱ����1molCO��2molH2��1molCH3OH���壬��ʱŨ��c��CO��=0.5mol/L+$\frac{1}{2}$mol/L=1mol/L��n��H2��=2��1-0.5��mol/L+$\frac{2mol}{2L}$=2mol/L��c��CH3OH��=0.5mol/L+$\frac{1mol}{2L}$=1mol/L����ʱŨ���Ϻ�Qc=$\frac{1}{1��{2}^{2}}$=0.25��K=1��ƽ�������ƶ���
��3����֪�ڳ��³�ѹ�£�
��2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��g����H1=-1277.0kJ/mol
��2CO��g��+O2��g��=2CO2��g����H2=-566.0kJ/mol
��H2O��g��=H2O��l����H3=-44kJ/molд���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��CH3OH��l��+O2��g��=CO��g��+2H2O��l����H=-443.5KJ/mol��
��4���״�������������ȼ�ϵ�أ�д������������Ϊ����ʼ״�ȼ�ϵ�ظ�����ӦʽCH3OH+8OH--6e-=CO32-+6H2O����ͼ�����KI��Һ�Ƶ⣬�ڴ��Թ��м��뱥�͵�KI��Һ��Ȼ���ټ��뱽������һ��ʯī�缫��һ�����缫��ʹ�ø�ȼ�ϵ������Դ�����缫�븺���������������ӣ�ͨ��һ��ʱ��Ͽ���Դ�����Թܣ��ϲ���ҺΪ�Ϻ�ɫ������1.27g �ⵥ������ʱ����Ҫ0.053g CH3OH��
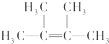 ��������2��3-����-2-��ϩ��
��������2��3-����-2-��ϩ��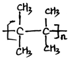 ��
�� ����CH3CH2��2C=CH2������˳���칹����
����CH3CH2��2C=CH2������˳���칹����