题目内容
17.KClO3和浓盐酸在一定温度下反应可表示为2KClO3+4HCl(浓)═2KCl+2ClO2↑+1Cl2↑+2H2O(1)请配平上述化学方程式.
(2)标出电子转移方向和数目

(3)氧化剂是KClO3,还原产物是Cl2.(写化学式)
(4)浓盐酸在反应中显示出来的性质是②(填编号).
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(5)产生0.1mol Cl2,转移电子的物质的量为0.2mol.
分析 KClO3中氯元素化合价由+5价降低为ClO2中+4价,化合价降低1价;HCl中氯元素化合价由-1价升高为Cl2中0价,化合价升高2价,化合价升降最小公倍数为2,故ClO2系数为2,Cl2系数为1;再结合元素守恒,配平各物质的系数,以此解答(1)~(3);
(4)根据HCl中氯元素化合价由-1价升高为Cl2中0价可知,HCl中氯元素被氧化,HCl在反应中还原剂与酸的作用,各占一半,生成盐体现酸性;
(5)反应中只有Cl2是氧化产物,HCl中氯元素化合价由-1价升高为Cl2中0价,据此计算转移电子物质的量.
解答 解:(1)KClO3中氯元素化合价由+5价降低为ClO2中+4价,化合价降低1价;HCl中氯元素化合价由-1价升高为Cl2中0价,化合价升高2价,化合价升降最小公倍数为2,故ClO2系数为2,Cl2系数为1;所以KClO3系数为2,KCl系数为2,HCl系数为4,水的系数是2,反应为2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O,
故答案为:2;4;2;2;1;2;
(2)该反应中转移电子为2e-,则电子转移的方向和数目为:
故答案为: ;
;
(3)Cl元素的化合价降低,则KClO3为氧化剂,得到电子被还原,还原产物为Cl2,故答案为:KClO3;Cl2;
(4)反应2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O中,HCl中氯元素化合价由-1价升高为Cl2中0价可知,HCl中氯元素被氧化,且生成KCl,体现HCl的还原性、酸性.
故答案为:②;
(5)反应中只有Cl2是氧化产物,HCl中氯元素化合价由-1价升高为Cl2中0价,所以产生0.1molCl2,转移的电子的物质的量为0.1mol×2=0.2mol,
故答案为:0.2.
点评 本题考查氧化还原反应,为高频考点,把握发生的反应及元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意电子转移的表示方法及盐酸的作用,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 丙酸和乙酸甲酯 | B. | 蔗糖和麦芽糖 | C. | 麦芽糖和纤维素 | D. | 苯甲酸和苯甲醛 |
 )的过程中,欲使原子利用率达到最高,还需要其他的反应物是( )
)的过程中,欲使原子利用率达到最高,还需要其他的反应物是( )| A. | CO和CH3OH | B. | CO2和H2O | C. | H2和CO2 | D. | CH3OH和H2 |
| A. | 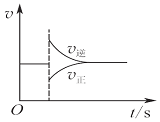 图可以表示对某化学平衡体系改变温度后反应速率随时间的变化 | |
| B. | 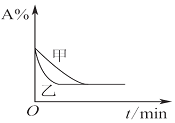 图表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(g)的影响,且甲的压强大 | |
| C. | 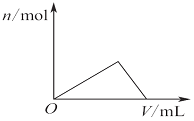 图表示向Al2(SO4)3和MgSO4的混合液中滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液体积的关系 | |
| D. | 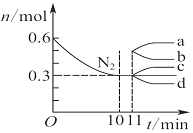 图表示在2 L的密闭容器中发生合成氨反应时N2的物质的量随时间的变化曲线,0~10 min内该反应的平均速率v(H2)=0.045 mol•L-1•min-1,从11 min起其他条件不变,压缩容器的体积为1 L,则n(N2)的变化曲线为d |
①2A-+C2═2C-+A2
②2C-+B2═2B-+C2
则有关说法中不正确的是( )
| A. | 氧化性:B2>C2>A2 | |
| B. | 在含有C-和A-的溶液中加入B2,C-优先发生反应 | |
| C. | 还原性:A->C->B- | |
| D. | 在含有B2和C2的溶液中加入A-,B2优先发生反应 |
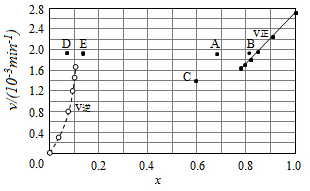 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,写出该反应的离子方程式2I-+MnO2+4H+=Mn2++I2+2H2O.
(2)一种碘和氧的化合物(I4O9),可以称为碘酸碘,则I4O9中碘元素的化合价是CD.
A.-1 B.+1 C.+3 D.+5
(3)若IOH是两性化合物,写出IOH的酸式电离的电离方程式IOH?H++IO-.
(4)已知反应2HI(g)═H2(g)+I2(g)△H=+11kJ•mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为299kJ.
(5)Bodensteins研究了下列反应:2HI(g)?H2(g)+I2(g).在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
②上述反应中,正反应速率为υ正=k正•x2(HI),逆反应速率为υ逆=k逆•x(H2)•x(I2),其中k正、k逆为速率常数,则k逆为$\frac{{K}_{正}}{K}$(以K和k正表示).
③由上述实验数据计算得到υ正~x(HI)和υ逆~x(H2)的关系可用如图表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为AE(填字母).
| A. | 仅含有Na+、H+、OH-、CH3COO-四种离子的某溶液中可能存c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| B. | 浓度相等的CH3COOH溶液与NaOH溶液混合后显中性,c(Na+)>c(CH3COO-)>c(OH-)=c(H+) | |
| C. | 常温下,pH=2的醋酸与pH=12的氢氧化钠等体积混合后,混合液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 将pH=8.5的氨水加水稀释后,溶液中所有离子的浓度均降低 |
| A. | 存在的电离平衡为:HCO3-+H2O?H2CO3+OH- | |
| B. | c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| C. | c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) | |
| D. | HCO3-的电离程度大于HCO3-的水解程度 |