题目内容
16.用KMnO4氧化盐酸溶液.反应方程式如下:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,若产生的Cl2在标准状况下体积为56L,计算
(1)参加反应的HCl的物质的量?
(2)反应中被氧化的HCl的物质的量?
(3)并用双线桥标出电子转移的方向和数目.
分析 反应生成Cl2在标准状况下体积为56L,根据n=$\frac{V}{{V}_{m}}$计算物质的量,再根据方程式计算HCl,结合元素化合价的变化分析.
解答 解:(1)反应生成Cl2在标准状况下体积为56L,则氯气的物质的量为n=$\frac{V}{{V}_{m}}$=$\frac{56L}{22.4L/mol}$=2.5mol,则参加反应的HCl的物质的量为2.5mol×$\frac{16}{5}$=8mol;
答:参加反应的HCl的物质的量为8mol;
(2)反应中16molHCl只有8mol被氧化,即被氧化的HCl占总的HCl物质的量$\frac{1}{2}$,所以反应中被氧化的HCl的物质的量为4mol;
答:反应中被氧化的HCl的物质的量为4mol;
(3)2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O+2KCl中,Mn元素的化合价降低,Cl元素的化合价升高,该反应转移10e-,双线桥标出电子的转移方向和数目为 ,
,
答:并用双线桥标出电子转移的方向和数目 .
.
点评 本题考查物质的量的计算、化学方程式计算、氧化还原反应,题目难度不大,注意对基础知识的理解掌握,明确元素化合价的变化以及反应中各物质之间的关系是解题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.开发清洁能源是当今研究的热点问题.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)?CH3OH(g)△H1=-99kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ•mol-1
(1)催化反应室中的总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g),计算△H=-262.7kJ•mol-1.反应原料来自煤的气化.已知该反应的平衡常数表达式为K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$,每生成1mol H2需要吸收131.3kJ的热量.写出该反应的热化学方程式C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ•mol-1.
(2)在该条件下,若反应①的起始浓度分别为:c(CO)=0.6mol•L-1,c(H2)=1.4mol•L-1,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为0.075mol•L-1•min-1.
(3)在t℃时,反应②的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
此时刻v正>v逆(填“>”“<”或“=”),平衡时c(CH3OCH3)的物质的量浓度是1.2mol•L-1.
(4)在(1)小题中催化反应室的总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g),CO的平衡转化率a(CO)与温度、压强的关系如图1所示,图中X代表温度(填“温度”或“压强”)判断的理由是图中表明随着X增大,CO的平衡转化率减小;如果X表示压强,压强增大,平衡向正反应方向移动,CO的平衡转化率增大,不符合条件;如果X表示温度,温度升高,平衡向逆反应方向移动,CO的平衡转化率减小,符合条件
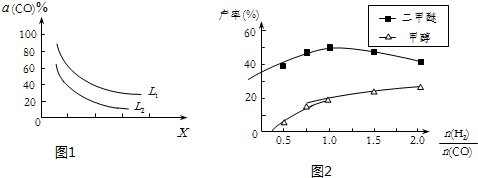
(5)在催化剂的作用下同时进行三个反应,发现随着起始投料比$\frac{n({H}_{2})}{n(CO)}$的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图2的变化趋势.试解释二甲醚产率和甲醇产率变化的原因:当投料比小于1时,随着c(H2)增大,反应①的平衡正向移动,CO转化率增大,因此二甲醚和甲醇的产率增大;当投料比大于1时,随着c(H2)增大,反应③被抑制,c(H2O)增大,最终抑制反应②,因此甲醇的产率继续增大而二甲醚的产率减小.
①CO(g)+2H2(g)?CH3OH(g)△H1=-99kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ•mol-1
(1)催化反应室中的总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g),计算△H=-262.7kJ•mol-1.反应原料来自煤的气化.已知该反应的平衡常数表达式为K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$,每生成1mol H2需要吸收131.3kJ的热量.写出该反应的热化学方程式C(s)+H2O(g)=H2(g)+CO(g)△H=+131.3kJ•mol-1.
(2)在该条件下,若反应①的起始浓度分别为:c(CO)=0.6mol•L-1,c(H2)=1.4mol•L-1,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为0.075mol•L-1•min-1.
(3)在t℃时,反应②的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c(mol•L-1) | 0.46 | 1.0 | 1.0 |
(4)在(1)小题中催化反应室的总反应3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g),CO的平衡转化率a(CO)与温度、压强的关系如图1所示,图中X代表温度(填“温度”或“压强”)判断的理由是图中表明随着X增大,CO的平衡转化率减小;如果X表示压强,压强增大,平衡向正反应方向移动,CO的平衡转化率增大,不符合条件;如果X表示温度,温度升高,平衡向逆反应方向移动,CO的平衡转化率减小,符合条件

(5)在催化剂的作用下同时进行三个反应,发现随着起始投料比$\frac{n({H}_{2})}{n(CO)}$的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图2的变化趋势.试解释二甲醚产率和甲醇产率变化的原因:当投料比小于1时,随着c(H2)增大,反应①的平衡正向移动,CO转化率增大,因此二甲醚和甲醇的产率增大;当投料比大于1时,随着c(H2)增大,反应③被抑制,c(H2O)增大,最终抑制反应②,因此甲醇的产率继续增大而二甲醚的产率减小.
7.互为同分异构体,且可用银镜反应区别的是( )
| A. | 丙酸和乙酸甲酯 | B. | 蔗糖和麦芽糖 | C. | 麦芽糖和纤维素 | D. | 苯甲酸和苯甲醛 |
11.下列金属的冶炼原理中,属于热分解法的是( )
| A. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ | B. | Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2↑ | ||
| C. | Fe+CuSO4═FeSO4+Cu | D. | 2NaCl(熔融)$\frac{\underline{\;通电\;}}{\;}$2Na+Cl2↑ |
1.下列有关离子(或物质)的检验及结论,正确的是( )
| A. | 向某无色溶液中加入BaCl2溶液有白色沉淀出现,再加入稀盐酸,沉淀不消失,则该溶液中一定含有SO42- | |
| B. | 焰色反应试验中,透过蓝色钴玻璃,可观察到Na+离子火焰呈黄色 | |
| C. | 检验Na2CO3固体中是否混有NaHCO3,可向固体滴加稀盐酸,观察是否产生体 | |
| D. | 用丁达尔效应可鉴别FeCl3溶液和Fe(OH)3胶体 |
8.“绿色化学”是当今社会提出的一个新概念.在“绿色化学工艺中,理想状态是反应物中原子全部转化为欲制的产物,即原子的利用率为100%.在用丙炔合成2-甲基丙烯酸甲酯 )的过程中,欲使原子利用率达到最高,还需要其他的反应物是( )
)的过程中,欲使原子利用率达到最高,还需要其他的反应物是( )
 )的过程中,欲使原子利用率达到最高,还需要其他的反应物是( )
)的过程中,欲使原子利用率达到最高,还需要其他的反应物是( )| A. | CO和CH3OH | B. | CO2和H2O | C. | H2和CO2 | D. | CH3OH和H2 |
5.化学中常用图象直观地描述化学反应的进程或结果,下列图象描述正确的是( )
| A. | 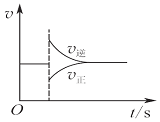 图可以表示对某化学平衡体系改变温度后反应速率随时间的变化 | |
| B. | 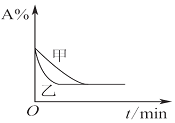 图表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(g)的影响,且甲的压强大 | |
| C. | 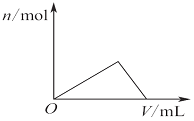 图表示向Al2(SO4)3和MgSO4的混合液中滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液体积的关系 | |
| D. | 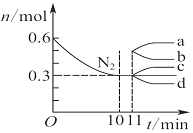 图表示在2 L的密闭容器中发生合成氨反应时N2的物质的量随时间的变化曲线,0~10 min内该反应的平均速率v(H2)=0.045 mol•L-1•min-1,从11 min起其他条件不变,压缩容器的体积为1 L,则n(N2)的变化曲线为d |
6.关于小苏打水溶液的表述正确的是( )
| A. | 存在的电离平衡为:HCO3-+H2O?H2CO3+OH- | |
| B. | c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| C. | c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) | |
| D. | HCO3-的电离程度大于HCO3-的水解程度 |