题目内容
11. NH3在工农业生产中具有重要的作用,可以用来生产尿素等化学肥料,也可以用来制备一些配位化合物.
NH3在工农业生产中具有重要的作用,可以用来生产尿素等化学肥料,也可以用来制备一些配位化合物.(1)合成氨是人类科学技术上的一项重大突破,工业合成氨生产中常用铁触媒作催化剂.请写出Fe元素的基态原子的价电子排布式:3d64s2.
(2)CO2+2NH3$\frac{\underline{\;催化剂\;}}{△}$CO(NH2)2+H2O,则CO(NH2)2分子中C原子的杂化方式为sp2.其中C、N、O三种元素的第一电离能由小到大的顺序为C<O<N.
1mol CO(NH2)2中含有σ键的数目为7NA.
(3)向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的[Cu(NH3)4]SO4•H2O晶体,与该物质中的配体互为等电子体的阴离子的化学式为CH3-.
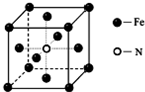
(4)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图,写出该反应的化学方程式8Fe+2NH3$\frac{\underline{\;640℃\;}}{\;}$2Fe4N+3H2.
分析 (1)铁是26号元素,基态原子核外有26个电子,3d、4s能级上电子是其价电子,根据构造原理书写其基态价电子排布式;
(2)计算杂化类型时根据电子对数来判断,中心原子的价电子数与配体电子数的和除以2就得到电子对数,根据电子对数,可以确定杂化类型;C、O、N元素都是第二周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能C<O<N,据此答题;
(3)[Cu(NH3)4]SO4•H2O配体是氨气,互互为等电子体的阴离子的化学式为CH3-;
(4)铁和氨气在640℃可发生置换反应生成氢气和氮化铁,利用均摊法确定氮化铁的化学式,根据温度、反应物和生成物写出反应方程式.
解答 解:(1)铁是26号元素,基态原子核外有26个电子,3d、4s能级上电子是其价电子,根据构造原理知其价电子排布式为:3d64s2;
故答案为:3d64s2;
(2)中心原子为碳,价电子数为4,氧不为中心原子,不提供电子,每个亚氨基提供一个电子,电子对数为(4+1×2)÷2=3,故杂化轨道为sp2,C、O、N元素都是第二周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能C<O<N,一分子尿素中含σ键的数目为3+2×2=7,故每摩尔尿素中含有σ键的数目为7NA,
故答案为:sp2;C<O<N;7NA;
(3)[Cu(NH3)4]SO4•H2O配体是氨气,互互为等电子体的阴离子的化学式为CH3-,故答案为:CH3-;
(4)该晶胞中铁原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$,氮原子个数是1,所以氮化铁的化学式是Fe4N,铁和氨气在640℃可发生置换反应生成氮气和氮化铁,所以该反应方程式为:8Fe+2NH3$\frac{\underline{\;640℃\;}}{\;}$2Fe4N+3H2,故答案为:8Fe+2NH3$\frac{\underline{\;640℃\;}}{\;}$2Fe4N+3H2.
点评 本题考查较综合,涉及电子数排布式的书写、杂化方式的判断、第一电离能、晶胞的计算等,难点是晶胞的计算和化学方程式的书写,难度中等,侧重于考查学生的分析能力和计算能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案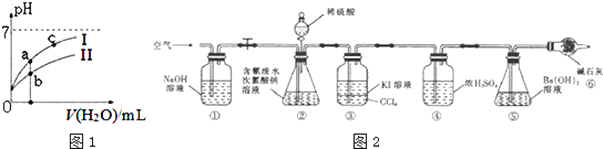
探究一:探究氰化物的性质
已知部分弱酸的电离平衡常数如表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数( 25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
(2)如图1表示常温下,稀释HCOOH、HCN两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是CD
A.相同浓度的HCOONa和NaCN的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(CN-)>c(HCOO-)>c(OH-)>c(H+)
B.向NaCN溶液中通入少量二氧化碳的离子方程式为:CN-+CO2+H2O═HCN+CO32-
C.图象中a、c两点处的溶液中$\frac{c({R}^{-})}{c(HR)•c(O{H}^{-})}$相等(HR代表HCOOH或HCN)
D.图象中a点酸的总浓度小于b点酸的总浓度
(3)H2O2有“绿色氧化剂”的美称;也可消除水中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O═A+NH3↑,则生成物A的化学式为KHCO3.
(4)处理含CN-废水时,如用NaOH溶液调节pH至9时,此时c(CN-)<c(HCN)(填“>”、“<”或“=”)
探究二:测定含氰水样中处理百分率
为了测定含氰水样中处理百分率,同学们利用如图2所示装置进行实验.将CN-的浓度为0.2000mol/L的含氰废水100mL与100mL NaClO溶液(过量)置于装置②锥形瓶中充分反应.打开分液漏斗活塞,滴人100mL稀H2SO4,关闭活塞.
已知装置②中发生的主要反应依次为:CN-+ClO-═CNO-+Cl-,2CNO-+2H++3C1O-═N2↑+2CO2↑+3C1-+H2O
(5)①和⑥的作用是吸收空气中二氧化碳排除空气中二氧化碳对实验的干扰.
(6)反应结束后,缓缓通人空气的目的是使生成的气体全部进入装置⑤.
(7)为了计算该实验装置②锥形瓶中含氰废水被处理的百分率,实验中需要测定装置⑤反应前后的质量(从装置①到⑥中选择,填装置序号).
| A. | 丙烯醛的结构简式:CH2═CHCHO | |
| B. | CSO的电子式: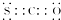 | |
| C. | 硫酸氢钠熔融时的电离方程式:NaHSO4═Na++HSO4- | |
| D. | S2-的结构示意图: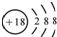 |
| A. | 25℃时,pH=4.5的硫酸溶液中c(H+) 是pH=5.5的磷酸中c(H+)的10倍 | |
| B. | 因为合金在潮湿的空气中易形成原电池,所以合金的耐腐蚀性都较差 | |
| C. | 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 | |
| D. | 常温下,2NO(g)+O2(g)?2NO2(g)能够自发进行,则该反应的△H<0 |
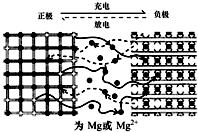 镁离子电池以金属镁或镁合金为负极,以能嵌入镁离子的化合物为正极,其工作原理如图所示,反应原理为:xMg+Mo3S4$?_{充电}^{放电}$ MgxMo3S4,下列说法不正确的是( )
镁离子电池以金属镁或镁合金为负极,以能嵌入镁离子的化合物为正极,其工作原理如图所示,反应原理为:xMg+Mo3S4$?_{充电}^{放电}$ MgxMo3S4,下列说法不正确的是( )| A. | 放电时,电池中的Mg2+从负极移向正极 | |
| B. | 其负极反应为:xMg-2xe-+Mo3S42x-═MgxMo3S4 | |
| C. | 充电时阳极反应式:MgxMo3S4-2xe-═Mo3S4+xMg2+ | |
| D. | 由于镁的密度较小,且Mg2+携带两个正电荷,这为高能量电池的设计提供了一个可靠依据 |
| A. | 0.1 mol/LCH3COONa溶液与0.1 mol/LCaCl2溶液等体积混合:c(Na+)+c(Ca2+)═c(CH3COO-)+c(CH3COOH)+2c(Cl- ) | |
| B. | 将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体后的溶液:c(H+)+c(H2CO3)═c(OH-)+c(CO32-)+c(NH3•H2O) | |
| C. | 0.1 mol/LCH3COONa溶液与0.1 mol/LHCl溶液混合至pH=7:c(Na+)>c(Cl-)=c(CH3COOH)>c(CH3COO-) | |
| D. | 0.2mol/L氨水与0.1 mol/LHCl溶液等体积混合:c(Cl-)+c(H+)═c(NH3•H2O)+c(OH-) |
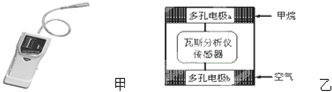
下列有关叙述正确的是( )
| A. | 电极b是正极,O2-由电极a流向电极b | |
| B. | 瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a | |
| C. | 当固体电解质中有1 mol O2-通过时,电子转移4 mol | |
| D. | 电极a的反应式为:CH4+5O2--8e-═CO32-+2H2O |
 ).在食用油的使用过程中,如果忘记盖上盖子,时间一长,食用油就会有一股特殊的气味-“哈喇”味.下列说法不正确的是( )
).在食用油的使用过程中,如果忘记盖上盖子,时间一长,食用油就会有一股特殊的气味-“哈喇”味.下列说法不正确的是( )| A. | 油酸甘油酯是一种不饱和高级脂肪酸甘油酯 | |
| B. | 油酸甘油酯可以使酸性高锰酸钾溶液褪色 | |
| C. | 1mol油酸甘油酯完全水解可以得到3mol C17H33COOH | |
| D. | 食用油变味是由于食用油发生了水解产生了甘油 |



