题目内容
1.氮化钠和氢化钙都是离子化合物,与水反应的化学方程式(末配平)如下:Na3N+H2O→NaOH+NH3,CaH2+H2O→Ca(OH)2+H2.有关它们的叙述正确的是( )| A. | 离子半径的大小:Na+>N3->H- | |
| B. | 它们与水发生的反应均属于氧化还原反应 | |
| C. | 两种化合物均只含离子键,不含共价键 | |
| D. | 两固体混合物溶于足量盐酸中可得到三种盐 |
分析 A.根据离子半径的判断标准,核外电子层数多的大于核外电子层数少的,当核外电子层数相同时,核内质子数大的离子半径小;
B.氧化还原反应中一定有电子的转移和化合价的升降;
C.Na3N、CaH2只含有离子键;
D.氮化钠和盐酸反应会生成氯化钠、氯化铵两种盐,氢化钠与盐酸反应会生成氯化钠.
解答 解:A.电子层越多,半径越大,所以氢离子半径最小,电子层一样,核电荷数越多,半径越小,所以Na+<N3-,即N3->Na+>H+,故A错误;
B.Na3N+H2O→NaOH+NH3 该反应中没有元素化合价发生变化,不属于氧化还原反应,故B错误;
C.Na3N、CaH2只含有离子键,不存在共价键,故C正确;
D.氮化钠和盐酸反应会生成氯化钠、氯化铵两种盐,氢化钠与盐酸反应会生成氯化钠,可得到三种盐,故D正确.
故选CD.
点评 本题考查了钠及其化合物的性质,涉及离子半径大小比较、氧化还原反应的判断、原子结构的判断,题目难度不大,把握氧化还原反应的规律,准确判断元素的化合价是解题关键.

练习册系列答案
相关题目
18.某气体在标准状况下的密度为1.696g•L-1,则该气体可能是( )
| A. | CO | B. | N2 | C. | CO2 | D. | F2 |
16.下列有关化学基本概念的判断依据正确的是( )
| A. | 弱电解质:溶液的导电能力弱 | B. | 共价化合物:含有共价键 | ||
| C. | 离子化合物:含有离子键 | D. | 金属晶体:能够导电 |

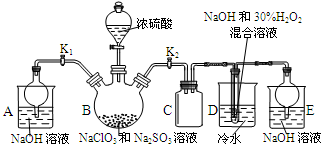 亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,请回答:
亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,请回答: