题目内容
10.解释下列事实的方程式不正确的有( )①漂白粉溶液在空气中失效:2ClO-+CO2+H2O═2HClO+CO32-
②次氯酸钠与浓盐酸反应产生Cl2:ClO+Cl-+H2O═Cl2↑+2OH-
③次氯酸钙溶液中通入二氧化硫:Ca+2ClO-+H2O+SO2═CaSO3↓+2HClO
④硫酸型酸雨放置一段时间的pH下降:2H2SO3+O2═2H2SO4.
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
分析 ①漂白粉溶液在空气中失效是因为次氯酸酸性比碳酸弱,次氯酸钙溶液中吸收二氧化碳反应生成碳酸钙和次氯酸;
②次氯酸钠与浓盐酸反应产生Cl2,是氯离子和次氯酸根离子在酸性溶液中发生氧化还原反应生成氯气;
③亚硫酸根离子具有强的还原性,能够被次氯酸氧化成硫酸根离子;
④亚硫酸被氧化为硫酸,酸性增强,pH下降.
解答 解:①次氯酸钙溶液中吸收二氧化碳反应生成碳酸钙和次氯酸,次氯酸见光分解失效,反应的离子方程式为:2ClO-+CO2+H2O+Ca2+═2HClO+CaCO3↓,故①错误;
②氯离子和次氯酸根离子在酸性溶液中发生氧化还原反应生成氯气,ClO-+Cl-+2H+═Cl2↑+H2O,故②错误;
③向次氯酸钙溶液中通入过量二氧化硫,离子方程式为:Ca2++2ClO-+2H2O+2SO2═CaSO4↓+SO42-+4H++2Cl-,故③错误;
④硫酸型酸雨放置一段时间溶液的pH下降,发生2H2SO3+O2=2H2SO4,故④正确;
不正确的有3个,
故选C.
点评 本题考查了物质性质,离子方程式书写和正误分析判断,主要是氧化还原反应产物的理解应用,题目难度中等.

练习册系列答案
相关题目
20.下列离子方程式书写正确的是( )
| A. | 向硫酸酸化的FeSO4溶液中加入过量的H2O2溶液:2Fe2++H2O2+2H+═2Fe3++2H2O | |
| B. | 用小苏打治疗胃酸过多:CO32-+2H+═CO2↑+H2O | |
| C. | 碳酸镁与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 向Ca(HCO3)2溶液中加入过量的NaOH溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
1.氮化钠和氢化钙都是离子化合物,与水反应的化学方程式(末配平)如下:Na3N+H2O→NaOH+NH3,CaH2+H2O→Ca(OH)2+H2.有关它们的叙述正确的是( )
| A. | 离子半径的大小:Na+>N3->H- | |
| B. | 它们与水发生的反应均属于氧化还原反应 | |
| C. | 两种化合物均只含离子键,不含共价键 | |
| D. | 两固体混合物溶于足量盐酸中可得到三种盐 |
18.下列有关物质用途的叙述不正确的是( )
| A. | 单质硅是光导纤维的主要成分 | B. | 氯气可用于自来水杀菌消毒 | ||
| C. | 氧化铁常用作红色油漆和涂料 | D. | 过氧化钠可用作潜艇里氧气的来源 |
2.将a g镁铝合金投入到x mL 1mol/L的盐酸中,金属完全溶解,再加入y mL 2mol/L NaOH溶液,沉淀达到最大值,质量为(a+3.4)g,则下列说法不正确的是( )
| A. | 镁铝合金与盐酸反应转移电子数为0.2NA | |
| B. | x=2y | |
| C. | 沉淀为Mg(OH)2和Al(OH)3的混合物 | |
| D. | a的取值范围为0.9<a<1.2 |
19.下列关于浓硫酸和浓硝酸的叙述正确的是( )
| A. | 浓硫酸和浓硝酸均具有强氧化性 | |
| B. | 浓硫酸和浓硝酸长期露置在空气中浓度均会增大 | |
| C. | 常温下浓硫酸和浓硝酸均不能用铝制容器贮存 | |
| D. | 浓硫酸和浓硝酸常温下均可以与Cu迅速反应 |
20.下列描述及热化学方程式均正确的是( )
| A. | 已知C2H6的燃烧热为1090 kJ•mol-1,则C2H6燃烧的热化学方程式为:C2H6(g)+3.5O2(g)═2CO2(g)+3H2O(g)△H=-1090 kJ/mol | |
| B. | 25℃,101kPa下,l mol C6H6燃烧生成CO2和液态水时放出3260 kJ热量,其热化学方程式为:C6H6(g)+7.5O2(g)=6CO2(g)+3H2O (l)△H=-3260kJ•mol-1 | |
| C. | 已知常温下:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,则稀醋酸与稀NaOH溶液反应生成1 mol H2O(l)时也放出57.3 kJ的热量 | |
| D. | 已知2CO(g)+O2(g)═2CO2(g)△H=-566 kJ•mol-1,则CO的燃烧热233kJ•mol-1 |
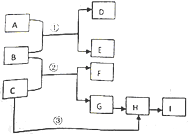 下列框图中物质均为中学化学常见物质.已知A、B、C均为有刺激性气味气体,A、B分别通入品红溶液中,红色均褪去;B、C分别通入紫色石蕊试液中,B使溶液先变红后褪色,C使溶液显蓝色;H为无色气体,I为红棕色气体,反应②有大量白烟生成.
下列框图中物质均为中学化学常见物质.已知A、B、C均为有刺激性气味气体,A、B分别通入品红溶液中,红色均褪去;B、C分别通入紫色石蕊试液中,B使溶液先变红后褪色,C使溶液显蓝色;H为无色气体,I为红棕色气体,反应②有大量白烟生成.